줄기세포 연구·개발 동향 보고서
- 역분화 만능 줄기세포를 중심으로 -
김태억 경제학 박사 (주)K2B
[목 차]
I. 개요
1. 세포 치료제
1) 세포 치료 방법
2) 세포 치료제의 종류
2. 줄기세포
1) 줄기세포의 종류
2) 줄기세포를 이용한 약물 개발
3) 질환별 줄기세포 치료제
1. 세포 치료제
1) 세포 치료 방법
2) 세포 치료제의 종류
2. 줄기세포
1) 줄기세포의 종류
2) 줄기세포를 이용한 약물 개발
3) 질환별 줄기세포 치료제
II. 줄기세포 관련 연구 동향
1. 줄기세포 생산 기술
1) 배아 줄기세포
2) 성체 줄기세포
3) 제대혈 줄기세포
2. 역분화 만능 줄기세포
1) 역분화 개념
2) 연구 결과 및 동향
3) 질병 모델
4) 문제점
3. 국내 연구개발 동향
1. 줄기세포 생산 기술
1) 배아 줄기세포
2) 성체 줄기세포
3) 제대혈 줄기세포
2. 역분화 만능 줄기세포
1) 역분화 개념
2) 연구 결과 및 동향
3) 질병 모델
4) 문제점
3. 국내 연구개발 동향
III. 줄기세포 시장
1. 주요 국가별 줄기세포 연구 지원 현황
2. 시장 분석
1. 주요 국가별 줄기세포 연구 지원 현황
2. 시장 분석
IV. 전망
V. Company Profile
VI. 참고 문헌
I. 개요
줄기세포(Stem Cell)는 미분화된 세포로서 모든 다세포 생물에 존재하며, 무한 증식이 가능한 자가 재생산 능력과 정상 염색체 유지 및 다양한 세포로의 분화 능력을 가지고 있으며, 1960년대에 캐나다 Ontario Cancer Institute의 Ernest A. McCulloch와 James E. Till에 의해 발견 된 이후, 특히 신체 210여개의 장기를 구성하는 조직의 어떠한 세포로도 분화 할 수 있다는 만능(Totipotent) 잠재력으로 인해 인체의 마스터 세포(Master cell)로 알려져 왔다.
줄기세포의 발견 및 연구를 통해 다양한 질환이나 상처들의 결손 된 세포, 혹은 상처 입은 세포들을 대치 할 수 있다는 희망을 가지게 되었고, 재생 치료 의학에 있어 줄기세포를 이용하는 새로운 혁신적인 방법의 장(場)을 열수 있게 되었다. 이러한 과정은 장기 이식 과정의 개념과 비슷할 수 있으나 장기 대신 세포 자체를 이용한다는 점에서 차이점을 가진다.
현재 줄기세포는 불치병 혹은 만족스러운 수준으로 치료되지 못하고 있는 만성적인 질환들에 대해 보다 효과적인 치료 방법을 제시 해 줄 수 있는 수단으로 평가 받고 있으며, 특별한 유전적 이상으로 인한 몇몇 질환들에 대해서는 실제 적용이 가능한 것으로 보고되고 있다. 2007년 후반의 통계에 따르면 성체 줄기세포에 기초를 둔 줄기세포 치료제 개발을 위해 미국에서만 700여개의 연구가 진행 중이었다고 한다.
이 보고서에서는 줄기세포에 대한 개요를 설명하고, 현재 및 미래에 있어 , 세포 치료제로서 줄기세포를 사용하기 위해 짚어봐야 할 과학적, 기술적 내용들에 대해 살펴보고자 한다.
1. 세포 치료제(Cell Therapy Products)
미국 FDA의 ‘세포 치료 및 유전자 치료에 관한 규정’에 따르면 세포 치료제란 ‘사람으로부터 분리, 배양 및 특수한 조작을 통해 제조된 세포 및 조직으로 치료, 진단 및 예방의 목적으로 사용되는 의약품’으로 정의된다.
국내 식품의약품안전청의 ‘생물학적 제제 등의 품목허가·심사 규정’ 고시 제 2008-78호 제 2조에 의하면 세포 치료제란 ‘살아있는 자가(Autologous), 동종(Allogenic), 이종(Xenogenic) 세포를 체외에서 배양·증식하거나 선별하는 등 물리적, 화학적, 생물학적 방법으로 조작하여 제조하는 의약품’을 말한다.
즉, 세포 치료제란 환자에게서 추출한 세포를 특정 환경에서 배양 및 조작하여 환자에게 다시 주입하거나, 세포로 인체 조직을 만들어 치료용으로 사용하는 기술을 말한다. 백혈구와 같은 면역 세포를 이용해 암을 치료하거나, 줄기세포를 이용해 연골이나 심장 근육을 재생하는 것과 같은 기술이 대표적인 세포 치료의 분야라고 할 수 있다.
1) 세포 치료 방법
(1) 자가(Autologous) 세포 치료
환자 자신의 조직 또는 세포를 이용하는 방법이다.
환자 자신의 조직 또는 세포를 이용하는 방법이다.
(2) 동종(Allogenic) 세포 치료
타인에게서 분리된 조직 또는 세포를 이용하는 치료 방법으로 면역 거부 반응의 문제점이 있을 수
타인에게서 분리된 조직 또는 세포를 이용하는 치료 방법으로 면역 거부 반응의 문제점이 있을 수
있다.
(3) 이종(Xenogenic) 세포 치료
다른 종(Species)으로부터 분리된 조직 또는 세포를 이용하게 되며, 바이러스 등의 감염이나 면
다른 종(Species)으로부터 분리된 조직 또는 세포를 이용하게 되며, 바이러스 등의 감염이나 면
역 거부 반응, 윤리적인 면에서의 문제점이 생길 수 있다.
(4) 세포주 유래 세포 치료
유전자 조작을 통해 불멸화된 세포주(Immortalized cell line)를 이용하며, 면역 거부 반응과 종양
유전자 조작을 통해 불멸화된 세포주(Immortalized cell line)를 이용하며, 면역 거부 반응과 종양
생성의 문제점이 있다.
2) 세포 치료제의 종류
세포 치료제는 사용하는 세포의 종류 및 분화 정도에 따라 크게 체세포 치료제와 줄기세포 치료제로 나눌 수 있으며, 줄기세포 치료제는 다시 배아 줄기세포 치료제, 성체 줄기세포 치료제로 분류 할 수 있다.
(1) 체세포(Somatic cell) 치료제
체세포를 이용한 치료로는 자가 연골 세포를 이용한 관절 연골 재생, 표피 세포를 이용한 피부 재생, Islet 세포를 이용한 당뇨병 치료, 파킨슨씨 질환(Parkinson's disease) 치료를 위한 Fetal neuronal 세포이용, 암 및 면역 질환에 있어 자연 살해 세포(Natural killer cell, NK cell) 이용, 각막 이식용 세포 등의 방법이 있다.
체세포를 이용한 치료로는 자가 연골 세포를 이용한 관절 연골 재생, 표피 세포를 이용한 피부 재생, Islet 세포를 이용한 당뇨병 치료, 파킨슨씨 질환(Parkinson's disease) 치료를 위한 Fetal neuronal 세포이용, 암 및 면역 질환에 있어 자연 살해 세포(Natural killer cell, NK cell) 이용, 각막 이식용 세포 등의 방법이 있다.
(2) 줄기세포(Stem cell) 치료제
줄기세포 치료제의 한 분류로, 줄기세포를 사람으로부터 분리, 분화와 증식을 거쳐 손상 된 장기 또는 조직의 기능 회복을 도울 수 있는 신경, 혈관, 근육 세포와 같은 기능성 세포 치료제와 단순 골수 이식이나 항암 면역 치료제로 수지상 세포(Dendritic cell)를 이용하는 성체 줄기세포 치료제가 있다. 또 다른 방법으로 배아 줄기세포를 이용한 치료제가 있는데 이 경우 세포의 대량 증식과 신체 모든 세포로 분화가 가능하다는 이점이 있으나 분화 조절이 어렵고, 암 발생 등의 문제점이 있다.
줄기세포 치료제의 한 분류로, 줄기세포를 사람으로부터 분리, 분화와 증식을 거쳐 손상 된 장기 또는 조직의 기능 회복을 도울 수 있는 신경, 혈관, 근육 세포와 같은 기능성 세포 치료제와 단순 골수 이식이나 항암 면역 치료제로 수지상 세포(Dendritic cell)를 이용하는 성체 줄기세포 치료제가 있다. 또 다른 방법으로 배아 줄기세포를 이용한 치료제가 있는데 이 경우 세포의 대량 증식과 신체 모든 세포로 분화가 가능하다는 이점이 있으나 분화 조절이 어렵고, 암 발생 등의 문제점이 있다.
2. 줄기세포
‘세포(Cell)'에 있어 ‘줄기세포(Stem Cell)'란 용어를 사용하기 위해서는 다음과 같은 특별한 기준을 만족해야 한다.
■ 자신을 복제 시킬 수 있는
■ 빠른 비율로 증식 할 수 있는
■ 세포 표면에 특정 단백질 - 뼈와 연골 같은 다른 조직들로 분화 할 수 있다는 능력의 표지자
■ 빠른 비율로 증식 할 수 있는
■ 세포 표면에 특정 단백질 - 뼈와 연골 같은 다른 조직들로 분화 할 수 있다는 능력의 표지자
(Indicator) -을 가지는
줄기세포주(Stem cell line)란 최초의 줄기세포 한 개로부터 내려온 세포의 그룹을 말한다. 인체 또는 적절한 실험실적 환경아래에서 줄기세포는 더 많은 세포들을 형성하기 위해 분열(Division)을 하지만 특화된 세포로 분화(Differentiation)되지는 않으며, ‘분열 정지’라는 의미의 화학적 신호가 충분하게 받아들여지기 전까지 계속 된다. 이러한 분열은 크게 대칭형 분열(Symmetric division)과 비대칭형 분열(Asymmetric division)이라는 두 가지의 방법으로 진행 된다.
○ 대칭형 분열(Symmetric division)
2개의 똑같은 딸세포(Daughter cell)를 형성하고, 형성된 2개의 딸세포 모두 줄기세포 특성을 부여 받는다.
2개의 똑같은 딸세포(Daughter cell)를 형성하고, 형성된 2개의 딸세포 모두 줄기세포 특성을 부여 받는다.
○ 비대칭형 분열(Asymmetric division)
1개의 줄기세포와 제한 된 자기 재생 능력을 가지는 1개의 전구체 세포(Progenitor cell)를 형성한다.
1개의 줄기세포와 제한 된 자기 재생 능력을 가지는 1개의 전구체 세포(Progenitor cell)를 형성한다.
전구체 세포는 몇 번의 세포 분열을 더 거쳐 최종적인 성숙 세포로 분화되고, 동시에 특별한 기능을 가지는 더욱 특화된 세포 - 혈액 세포, 뇌 세포, 심장 근육 또는 뼈 - 로의 분화를 시작하게 된다. 이러한 분화 능력에 따라 줄기세포를 분류 할 수 있으며, 그 내용은 다음과 같다.
○ 전능성(Totipotent) 줄기세포
배아(Embryonic) 줄기세포 또는 배외(Extraembryonic) 줄기세포로 분화가 가능하며, 정세포(Sperm cell)와 난세포(Egg cell)의 수정 또는 수정된 난자의 초기 분열을 통해 생성된다.
배아(Embryonic) 줄기세포 또는 배외(Extraembryonic) 줄기세포로 분화가 가능하며, 정세포(Sperm cell)와 난세포(Egg cell)의 수정 또는 수정된 난자의 초기 분열을 통해 생성된다.
○ 만능성(Pluripotent) 줄기세포
전능성(Totipotent) 줄기세포의 자손 세포이며, 삼배엽 - 외배엽(Ectoderm), 내배엽(Endoderm), 중배엽(Mesoderm) - 유래의 세포들로 분화 될 수 있다.
전능성(Totipotent) 줄기세포의 자손 세포이며, 삼배엽 - 외배엽(Ectoderm), 내배엽(Endoderm), 중배엽(Mesoderm) - 유래의 세포들로 분화 될 수 있다.
○ 다분화성(Multipotent) 줄기세포
조직 또는 기능에 있어 밀접하게 관련된 세포들만을 생성 할 수 있다.
조직 또는 기능에 있어 밀접하게 관련된 세포들만을 생성 할 수 있다.
○ 단분화성(Unipotent) 줄기세포
근육 줄기세포와 같이 한 종류의 세포만을 생성 할 수 있으나 자가 재생성 능력이 있어 줄기세포가 아닌 세포들과 구분이 가능하다.
근육 줄기세포와 같이 한 종류의 세포만을 생성 할 수 있으나 자가 재생성 능력이 있어 줄기세포가 아닌 세포들과 구분이 가능하다.
1) 줄기세포의 종류
위와 같은 능력을 가진 줄기세포는 배아 줄기세포, 성체 줄기세포, 제대혈 줄기세포와 같이 크게 3가지의 형태로 나누어 설명 할 수 있다.
(1) 배아 줄기세포(Embryonic Stem Cell, ES cell)
배아 줄기세포(ES cell)는 배아(Embryo)의 초기 발생 단계 중 하나인 포배(Blastocyst) 단계의 내부세포괴(Inner cell mass, ICM)에서 유래한다. 포배 단계에서의 배아는 수정 후 4 ~ 5일 정도 된 상태로, 50 ~ 150여개의 세포들을 가지고 있으며, 이 세포들은 더 많은 줄기세포로 분열하거나 삼배엽 세포로 분화할 수 있는 만능성(Pluripotent) 분화 능력을 가진 줄기세포들이다.
배아 줄기세포(ES cell)는 배아(Embryo)의 초기 발생 단계 중 하나인 포배(Blastocyst) 단계의 내부세포괴(Inner cell mass, ICM)에서 유래한다. 포배 단계에서의 배아는 수정 후 4 ~ 5일 정도 된 상태로, 50 ~ 150여개의 세포들을 가지고 있으며, 이 세포들은 더 많은 줄기세포로 분열하거나 삼배엽 세포로 분화할 수 있는 만능성(Pluripotent) 분화 능력을 가진 줄기세포들이다.
<포유동물의 배아 발생 과정>
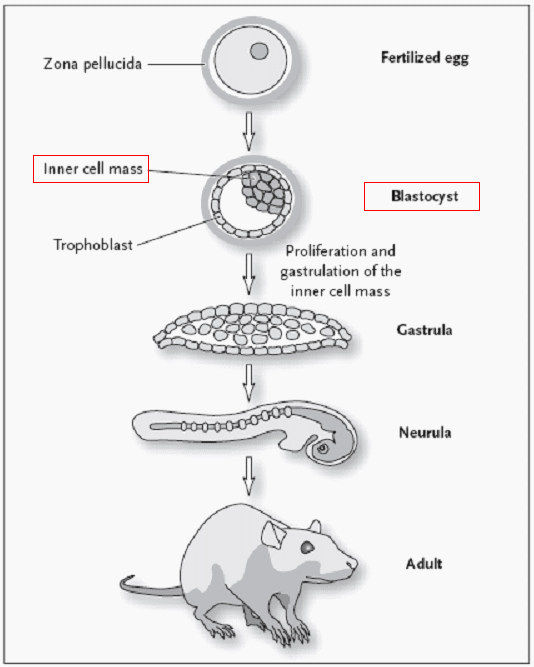
(출처 : Joseph Panno, Stem cell research-Medical applications & Ethical Controversy)
이러한 특성으로 인해 배아 줄기세포들은 성인 신체를 구성하는 200여개 이상의 세포 형태로 적절한 자극에 의해 분화 할 수 있는 능력을 가지게 되며, 그 사용에 있어서도 무궁무진한 가능성을 지니고 있다고 할 수 있다.
그러나 인간 배아 줄기세포의 사용 문제는 줄기세포를 얻는 과정에서 포배 단계의 배아가 파괴된다는 점 때문에 윤리적으로 매우 심각한 논란을 야기 시킬 수 있다. 보통 줄기세포를 얻는 배아의 경우 in vitro 수정을 통해 생산이 되고, 더 이상 원치 않는 혹은 필요 없다는 이유로 인해 여성의 자궁으로 이식되지는 않는다. 상당수 사람들은 수정란 상태의 착상 전 인간 배아도 인간(Human)이라고 여기며, 태어 날 수 있는 능력과 가능성을 결과적으로 끝내버리는 어떠한 행위도 도덕적으로 잘못 된 것이라고 생각한다. 그러나 또 다른 사람들은 포배 단계의 경우, 특별한 도덕적 혹은 법률적인 상태가 아닌, 단순한 세포들의 집합체라고 여기기도 한다. 현재 이러한 다양한 의견들에 의한 논란으로 인해 일부 국가들에 따라 그 사용과 금지가 나뉘고 있는 실정이다.
배아 줄기세포를 서로 다른 많은 형태의 세포들로 정확하고 정교하게 분화시키기 위해서는 특별한 신호 메커니즘과 그 메커니즘을 조절할 수 있는 능력이 필요하다. 이러한 점에 대한 고려 없이 인체 내에 직접 주사했을 경우에는 기형종(Teratoma)의 발생 같은 문제점이 생길 수 있다. 따라서 이러한 배아 줄기세포들의 무제한적 분열 능력과 만능성(Pluripotent) 특성이라는 복합적인 능력을 살려, 이식 거부 반응을 피하면서 사용 가능한 세포로 배아 줄기세포를 분화시키는 것이 중요한 도전 과제로 제시되고 있다.
(2) 성체 줄기세포(Adult Stem Cell, AS)
성체 줄기세포(AS cell)는 아이와 성인 모두를 포함해 발달된 기관에서 발견되는 세포들이기 때문에 'Adult Stem Cell'이란 용어 자체는 일부 잘못된 의미와 해석을 가질 수도 있다.
체세포(Somatic cell)로 알려진 성체 줄기세포는 대부분이 다분화성(Multipotent) 능력을 지니고 있어 계대에 있어 제한적이고, 모든 형태의 세포를 생산하지도 못하는 한계점을 지녀 배아 줄기세포에 비해 질환 치료에 있어 그 사용 가능성이 제한되어 왔다. 그러나 성체 줄기세포는 배아 줄기세포에 비해 윤리적인 논란에서 비교적 자유로운 이점을 가진다.
성체 줄기세포는 지속적인 세포 교체를 반복하는 기관에서 발견되며, 이러한 기관들에는 피부의 표피층, 소장(Small intestine)의 내막, 골수(Bone marrow), 뇌, 힘줄 등이 있다.
골수의 경우 혈액과 면역계의 모든 세포 형태로 분화가 되는 조혈 줄기세포(Hematopoietic Stem cell, HS cell)가 존재하며, 위치한 환경의 성장 인자에 따라 서로 다른 종류의 세포들로 분화가 된다. 또한 근육, 뼈, 지방 등의 중간엽 조직으로 분화되는 중간엽 줄기세포(Mesenchymal Stem cell, MSC)도 골수에 존재하여 신경, 피부와 같은 세포들로 분화가 될 수 있다.
이러한 분화 특성들이 알려지면서 다양한 기관들에 대한 세포 치료제로서 성체 줄기세포의 사용 가능성이 제기 되었고, 이러한 가능성은 윤리적인 배경 하에 배아 줄기세포의 사용을 반대해왔던 사람들에게 특히 환영을 받았으나, 배아 줄기세포에 비해 수명이 짧고 얻을 수 있는 양이 적어 실제 임상적으로 적용하기에는 어려운 단점을 가지고 있다.
(3) 제대혈 줄기세포(Cord Blood Stem Cell)
제대혈(Umbilical cord blood)이란 태반(Placenta)과 태아의 제대(Umbilical cord)로부터 나온 혈액을 말한다. 제대혈에는 줄기세포가 다량 존재하고 있어 줄기세포를 얻기 위한 공급원으로 이용 될 수 있으며, 또한 제대혈 줄기세포의 경우 골수 유래 줄기세포에 비해 증식(Proliferation)이 더 강한 특성을 가지고 있다.
제대혈(Umbilical cord blood)이란 태반(Placenta)과 태아의 제대(Umbilical cord)로부터 나온 혈액을 말한다. 제대혈에는 줄기세포가 다량 존재하고 있어 줄기세포를 얻기 위한 공급원으로 이용 될 수 있으며, 또한 제대혈 줄기세포의 경우 골수 유래 줄기세포에 비해 증식(Proliferation)이 더 강한 특성을 가지고 있다.
1978년도에 처음으로 인간 제대혈에서 조혈 줄기세포가 분리 된 이후로 1980년대 후반에는 혈연간 이식이 성공적으로 이루어졌으며, 백혈병(Leukemia), 림프종(Lymphoma) 및 60여개 이상의 유전적 이상 질환의 환자들에게 11,000회 이상 조혈 줄기세포 이식이 이루어진 것으로 보고되고 있다.
한편 성체 줄기세포에 덧붙여, 조직의 더 많은 형태로 분화할 수 있는 능력을 가진 줄기세포들이 제대혈에 존재할 수도 있다고 한다. 2005년도에 영국 Kingston 대학 연구자들에 의해 제대혈에서 CBEs(Cord-Blood-derived Embryonic-like stem cells)라는 이름으로 3번째 종류의 줄기세포가 발견되었다는 연구 결과가 보고 된 바 있는데, 연구 결과에 의하면, 간(Liver) 세포로 CBEs를 이식한 이후에 성체 줄기세포보다 더 많은 종류의 조직 형태로 세포들이 분화 되었다고 한다. 또한 CBEs는 배아 줄기세포의 표지자로 생각되는 대부분의 표면 단백질들을 가졌으며, 배아 줄기세포에 의해 형성되는 특징적인 세포 응집 현상인 ‘Embryonic bodies' 역시 형성되었다고 한다.
2) 줄기세포를 이용한 약물 개발
현재 줄기세포는 줄기세포 자체를 이용하는 치료제로서의 연구 이외에도 약물 개발 과정에서 새로운 물질의 스크리닝(Screening)을 위한 기술로서 그 가능성을 인정받고 있다. 동물 시험에서 발견하지 못한 부작용 또는 약물 효과의 유효성 부족으로 인해 임상 시험에 진입한 약물 중 90% 이상이 시장 진입에 실패를 하고 있는 현실로 미루어 볼 때, 화합물에 대한 문제점을 보다 효과적으로 스크리닝할 수 있는 시험 시스템 개발에 대한 가치와 중요성이 높아지고 있는 것이다.
글로벌 다국적 제약 기업인 GlaxoSmithKline(GSK), AstraZeneca와 Roche는 실험 의약품에 대한 안전성 시험에 있어 줄기세포를 사용하는 ‘Stem Cells for Safer Medicines Ltd.'란 이름의 새로운 벤처 회사 설립을 2007년 8월 발표한 바 있다. 이 회사의 경우 줄기세포 자체를 가능성 있는 치료제로 개발하기보다는, 인간 배아 줄기세포를 사용하여 임상 시험 진입 전에 새로운 약물에 있어 잠재적인 가능성이 있는 부작용을 스크리닝 할 수 있는 효과적인 방법 개발을 목표로 하고 있다. 또한 2007년 9월 EU 펀드에 의해 설립된 ’Stem Cell Sciences'라는 이름의 회사는 자체 특허가 있는 신경 줄기세포(Neural Stem cell, NS)를 이용한 신약 개발의 스크리닝 과정 개발에 다국가적인 노력을 기울이고 있다. 'NEUROscreen'이란 이름의 이 프로젝트는 신경 줄기세포를 기반으로 하는 생물학적 분석 방법 개발을 통해 암(Cancer), 알츠하이머 질환(Alzheimer's Disease), 뇌졸중(Stroke), 간질(Epilepsy) 등의 치료에 있어 신약 후보 물질 발굴을 목표로 하고 있다.
3) 질환별 줄기세포 치료제
현재 사용 또는 승인 된 줄기세포 치료제의 경우 대부분이 백혈병(Leukemia), 다발성 골수종(Multiple myeloma), 비호지킨 림프종(Non-Hodgkin‘s lymphoma)과 같은 암(Cancer) 관련 질환과 재생 불량성 빈혈(Aplastic anemia), 면역 결핍증, 루프스(Lupus)와 같은 질환들에 국한되어 있으며, 치료법 역시 골수(Bone marrow) 또는 혈액 내 줄기세포를 이용한 줄기세포 이식술의 형태로 대부분 진행되고 있다.
(1) 암(Cancer)
① 백혈병(Leukemia)
백혈병은 혈액 또는 골수(Bone marrow)에서 제어할 수 없을 정도로 백혈구가 증식하는 현상으로 인한 치명적인 암(Cancer)의 한 형태이다. 미국 국립 암 연구소(U. S. National Cancer Institute)의 통계에 의하면 세계적으로 매해 31,000명의 백혈병 환자가 공식적으로 진단이 된다고 한다.
백혈병의 대표적인 증상으로는 정상적인 골수 세포들이 매우 많은 수의 미성숙 백혈구들로 대치되면서 지혈 과정의 구성 성분 중 하나인 혈소판이 부족해져 쉽게 상처를 입고 과도한 출혈을 하는 증상이 생기게 된다. 또한 백혈구는 병원균 대응에 관계되어 있기 때문에 백혈병 환자의 면역계는 억제되어 있거나 인체 내 다른 세포를 공격하는 기능 이상 증세를 보인다.
이러한 백혈병은 암적인(Cancerous) 변화가 일어나는 부위에 따라 림프구성(Lymphocytic, lymphoblastic) 또는 골수성(Myelogenous, myeloid)으로 분류하기도 하며, 비정상적인 백혈구의 증식률에 따라 급성 혹은 만성으로 구분할 수도 있다.
○ 급성(Acute) 백혈병
미성숙 혈액 세포의 급속한 증식으로 인해 골수(Bone marrow)는 정상적인 세포의 생산을 못하게 되며, 모든 종류의 악성 질환들 중 미국 소아 사망 원인 중 대부분을 차지한다. 악성 세포들이 급속하게 축적되고, 혈액을 통해 신체 내의 다른 기관으로 퍼져 가기 때문에 매우 즉각적인 치료가 필요하다.
○ 만성(Chronic) 백혈병
만성 백혈병은 비정상 혈액 세포들의 과도한 생산 과정 진행에 있어 수개월에서 수년까지 시간이 걸린다는 점에서 급성 백혈병과 차이를 보이며, 대부분 성인에게서 발병한다.
모든 백혈병 형태의 치료 방법은 골수 및 전신병(Systemic disease) 조절을 위해 일반적으로 화학 요법을 사용하게 된다. 병의 진행 단계와 환자의 상태에 따라 줄기세포 이식술 역시 고려할 수 있으며, 이 경우 암(Cancer) 세포를 가지고 있는 비정상 골수의 파괴 현상을 대치할 수 있게 된다. 정상 줄기세포가 이식되면, 정상적인 세포들의 생산이 재개되고, 이식 된 세포들의 면역 인자에 의해 골수에 남아 있던 암세포들이 사멸하게 된다. 화학 요법에도 불구하고 백혈병이 재발한 환자의 경우에도 줄기세포 이식술을 생각할 수 있으며, 특히 급성 림프구성 백혈병 재발의 경우에는 화학 요법 후 동종 골수 이식술(Allogenic bone marrow transplant)이 추천된다. 만성 골수성 백혈병 환자의 경우에는 질환을 일으키는 염색체상의 이상(Abnormality)을 제거 할 수 있는 동종 골수 이식술에 의해 효과를 볼 수 있으며, 매우 고농도의 화학 요법과 방사선 치료 후에 공여자의 골수 이식이 이어지게 된다.
② 다발성 골수종(Multiple myeloma)
다발성 골수종은 항체를 생산하는 골수(Bone marrow)의 면역계 세포들인 형질 세포(Plasma cell)의 암(Cancer) 형태이다. 약 45,000명의 미국인들과 세계적으로는 약 945,000명이 다발성 골수종으로 고통을 겪고 있으며, 미국 암 학회(The American Cancer Society) 추정 매해 약 14,600명이 새롭게 다발성 골수종으로 진단받고 있다고 한다. 진단 후 평균 생존 기간은 약 3년 정도로 매우 치명적인 질환이며, 모든 암의 약 1%, 모든 암 사망의 약 2%를 나타내고, 비호지킨 림프종(Non-Hodgkin‘s lymphoma)에 이어 두 번째로 흔한 혈액암(10%)으로 보고되고 있다.
다발성 골수종은 항체를 생산하는 골수(Bone marrow)의 면역계 세포들인 형질 세포(Plasma cell)의 암(Cancer) 형태이다. 약 45,000명의 미국인들과 세계적으로는 약 945,000명이 다발성 골수종으로 고통을 겪고 있으며, 미국 암 학회(The American Cancer Society) 추정 매해 약 14,600명이 새롭게 다발성 골수종으로 진단받고 있다고 한다. 진단 후 평균 생존 기간은 약 3년 정도로 매우 치명적인 질환이며, 모든 암의 약 1%, 모든 암 사망의 약 2%를 나타내고, 비호지킨 림프종(Non-Hodgkin‘s lymphoma)에 이어 두 번째로 흔한 혈액암(10%)으로 보고되고 있다.
골수종(Myeloma)에 의해 다양한 기관(Organ)들이 영향을 받으며, 그 증상 역시 다양한 형태로 기타 질환들과 관련된 증상들을 대부분 포함한다. 일반적으로 골수종에 포함된 증상들은 다음과 같다.
■ 척추와 갈비뼈를 포함한 뼈 통증 (활동성에 따라 악화됨)
■ 폐렴, 신우신염(Pyelonephritis)과 같은 감염
■ 급성 및 만성 신장 이상증(Renal failure)
■ 빈혈증
■ 심약(Weakness), 혼란, 피로, 시각적 효과, 두통 등과 같은 다양한 신경학적 증상들
■ 폐렴, 신우신염(Pyelonephritis)과 같은 감염
■ 급성 및 만성 신장 이상증(Renal failure)
■ 빈혈증
■ 심약(Weakness), 혼란, 피로, 시각적 효과, 두통 등과 같은 다양한 신경학적 증상들
골수종(Myeloma)은 종양 세포의 증식과 인터류킨-6(Interleukin-6, IL-6)의 분비로 생기며, 인터류킨-6의 경우 외상성 장애(Trauma)에 대해 면역 반응을 촉진하며, 뼈 분해 기작에 있어 파골 세포(Osteoclast) 작용을 촉진한다. 뼈의 분해는 혈액 속으로의 칼슘 분비 양을 증가 시켜 고칼슘혈증(Hypercalcemia) 및 관련 증상을 일으키게 된다. 또한 항체 생산량의 감소와 정상 항체의 파괴가 증가하면서 면역계의 이상으로 감염에 대한 위험도가 높아지게 된다. 신장 이상(Renal failure) 역시 고칼슘혈증으로 인해 흔하게 발생하게 되며, Bence Jones 단백질 배출로 인한 세뇨관 장애, 사구체의 아밀로이드 침전, 고요산혈증(Hyperuricemia), 재발성 감염, 종양 세포의 국지적인 침투 등의 증상도 발생하게 된다. 빈혈증의 경우 종양 세포에 의해 정상적인 골수(Bone marrow)가 대치되고, 사이토카인(Cytokine)에 의해 정상 적혈구 생산이 저해되면서 발생한다. 신경학적인 증상 역시 고칼슘혈증과 혈액점도증가(Hyperviscosity) 현상으로 빈번하게 발생한다.
다발성 골수종(Multiple myeloma) 환자들 중 약 50%정도가 14번 염색체의 이상 및 13번 염색체의 부분적인 제거 현상을 보여 질환 발생에 있어 유전적인 요인이 큰 역할을 하는 것으로 생각되고 있다.
다발성 골수종(Multiple myeloma)에 대한 치료는 질환의 확대를 막고 억제시키는데 초점을 두고 있으며, 소아 환자의 경우에는 고용량의 화학 요법과 연이은 두 번의 자가(Autologous) 줄기세포 이식술이 매우 효과적일 수 있다. 자가 줄기세포 이식술에 대한 대체 방법으로 현재 비골수파괴성(Nonmyeloablative) 동종(Allogenic) 줄기세포 이식술이 연구 되고 있으나, 치료 효과에 비해 치료 과정에서의 사망률이 5 ~ 10%에 달한다는 점이 문제점으로 인식되고 있다.
③ 비호지킨 림프종(Non-Hodgkin‘s lymphoma)
19세기와 20세기를 거치면서 림프종(Lymphoma)은 1832년 림프종을 처음 발견한 Thomas Hodgkin의 이름을 따서 Hodgkin씨 병(Hodgkin's disease)이라 불리었으나, Reed-Sternberg 세포의 발견으로 비호지킨 림프종(Non-Hodgkin‘s lymphoma)과 구별하게 되었다. 두 가지 암(Cancer) 질환 모두 림프계를 공격하는 특성을 가지지만 서로 다른 특성의 세포들을 가진다는 점에서 차이점을 보이며, 병리학, 역학(Epidemiology), 발생 부위, 임상 증상 및 치료 등에 있어서도 구분이 되고, 비호지킨 림프종의 경우 비장(Spleen), 림프절(Lymph node), 편도선(Tonsil) 등과 같은 림프계 관련 기관에서 발생한다. 가장 흔한 증상은 목, 겨드랑이 밑, 샅(Groin)과 같은 부위에서 림프절이 커지는 형태로 고통은 동반하지 않으며, 이 외에도 열(Fever), 체중 감소, 식욕 부진, 피로 가려움증 및 발진 등의 증상이 나타난다.
대부분의 림프종들처럼 발병 원인은 아직 명확히 밝혀져 있지 않으며, 노화, 면역 체계 약화, 환경과 관련된 바이러스 출현, 살충제, 용매, 화학 비료 등과 같은 특정 화학 물질에 대한 노출 등이 위험 인자로 거론되고 있다. 2007년도 기준 미국 국립 암 연구소(U. S National Cancer Institute)의 통계에 의하면 63,190명이 진단을 받아 18,660명이 사망 한 것으로 보고되어 있다. 세계적으로는 매해 1.3백만 명 이상에서 질환이 발생되고 있다고 한다.
비호지킨 림프종(Non-Hodgkin‘s lymphoma)의 치료는 질환의 단계, 관련된 세포들의 형태 및 종류, 세포의 공격성 정도, 환자의 나이와 일반적인 건강 상태에 따라 달라 질 수 있다. 보통 화학 요법, 방사선 치료의 단독 또는 복합 치료가 사용되며, 비호지킨 림프종의 재발성 또는 위험도가 높은 경우 골수 이식술이 사용될 수 있다.
(2) 기타 질환
현재 줄기세포 이식술이 사용되고 있는 기타 질환들은 다음과 같다
현재 줄기세포 이식술이 사용되고 있는 기타 질환들은 다음과 같다
① 재생 불량성 빈혈(Aplastic anemia)
재생 불량성 빈혈(Aplastic anemia)은 골수(Bone marrow)의 기능 이상으로 인해 혈액 세포를 계속 공급할 만큼 충분한 새로운 세포들을 골수에서 만들어 내지 못하는 상태를 말하며, 일반적인 빈혈(Anemia)의 경우 적혈구의 수가 적은 상태를 말하지만 재생 불량성 빈혈 환자는 3가지 형태 - 적혈구, 백혈구, 혈소판 - 의 혈액 세포 수가 모두 낮은 상태를 말한다. 증상은 질환 상태에 따라 달라지며 출혈과 타박상, 감염의 위험도 증가와 함께 육체적 불쾌(불안)감을 느끼게 된다. 빈혈은 미국과 유럽 인구의 약 4 ~ 5% 비율로 흔한 질환인데 반해 재생 불량성 빈혈은 미국의 경우 매해 500 ~ 1,000명 정도, 아시아 국가들에서는 2 ~ 3배 정도 많은 것으로 추정되는 비교적 드문 질환이다.
재생 불량성 빈혈은 백혈구가 골수를 공격하는 자가 면역성 이상(Autoimmune disorder)의 특성을 띠며, 급성 바이러스성 간염 환자 중 약 2% 정도가 재생 불량성 빈혈 증상을 동반하여 바이러스성 간염과도 부분적으로 연관되어 있다. 또한 벤젠(Benzene), 방사선(Radiation), Chloramphenicol, Carbamazepine, Phenytoin, Quinine, Phenylbutazone 등의 특정 약물의 사용과도 관련되어 있다.
재생 불량성 빈혈은 항흉선세포 글로불린(Anti-thymocyte globulin), 시클로스포린(Cyclosporin), 화학 요법 등과 같은 약물 제제의 사용으로 면역계 억제를 통해 치료하며, 좀 더 심한 상태의 경우 골수 이식술을 고려 할 수 있다. 이식된 골수는 환자에서 기능 이상이 있는 골수 세포들을 대치하여 새로운 골수의 줄기세포로부터 적혈구, 백혈구, 혈소판의 세 가지 모든 혈액 세포들을 재생산하게 된다.
② 면역 결핍증(Immunodeficiency)
선천성 면역 결핍 질환들은 면역계의 내재적인 혹은 유전적인 결함에 의해 발생하며, 선천성 면역 결핍증으로 판명되기 위해서는 면역 결핍의 원인에 있어 AIDS, 약물 치료, 독소에 대한 환경 노출 등과 같은 기타 질환들에 의해 발생되지 않아야 한다. 선천성 면역 결핍증의 대부분은 유전적 이상에 의한 질환들이며, 대부분의 경우 소아기(Young children)에 진단된다. 면역 결핍증의 일반적인 증상들로는 재발성 또는 지속성 감염, 피부, 심장, 안면 발달 및 골격계 등 특정 기관의 이상 증세가 있을 수 있다.
선천성 면역 결핍증의 대부분의 형태는 위험하지 않은 것으로 알려져 있지만, T- & B-림프계의 심각한 결함으로 특징지어지는 중증 합병형 면역결핍증(Severe Combined Immunodeficiency)의 경우에는 치명적일 수 있다. 대부분의 일반적인 SCID의 경우 X 염색체와 연관되어 남성에게만 영향을 미치지만 또 다른 SCID 형태의 경우 상염색체(Autosomal) 열성 유전 경향을 가지거나 자연 돌연변이(Spontaneous mutation)의 결과로 발생한다. SCID의 대략적인 발생 비율은 백만 명당 한명 정도이며, 전 세계적으로 약 6,500명이하의 환자가 있는 것으로 추정된다.
면역 결핍증의 예방을 위해서는 감염원에 대한 노출을 줄이고, 예방적 항생제(Prophylactic antibiotics)를 사용하는 것을 추천하며, 기타 치료법으로는 항체 결핍증의 경우 정맥 투여용 면역 항체 글로불린(Intravenous Immunoglobulin, IVIG)을 사용하거나 SCID의 경우 조혈 줄기세포 이식술을 이용하는 방법 등이 있다. 또한 유전자 치료 방법으로서 선천성 면역 결핍증 환자의 비정상 질환 유전자를 대체/복구하기 위해 환자의 혈액 또는 골수로부터 면역계 관련 세포를 채집하여 정상 유전자를 삽입하고 실험실적 조건에서 증식 시킨 후 환자에게 다시 세포를 수혈하는 방법이 있을 수 있으며, 환자의 비정상적인 유전자를 세포 내에서 복구하는 방법도 있을 수 있다. 다만 유전자 치료에 대한 심각한 부작용들이 보고되고 있어 향후 일반적인 사용 승인을 위해서는 추가적인 연구와 임상 시험이 필요할 것으로 보인다.
③ 루푸스(Lupus)
루푸스(Lupus) 또는 전신성 루푸스 erythematosus는 면역계가 인체 내 자신의 세포와 조직을 공격하는 만성(Chronic) 자가 면역(Autoimmune) 질환으로 대개 심장, 관절, 피부, 폐, 혈관, 간, 신장, 신경계 등을 손상시키게 된다. 질환의 진행 과정은 예측할 수 없으며, 모든 연령대에서 발생 가능하나 대부분 비유럽인 여성에게서 흔히 발병하고, 특히 가임기(Childbearing age) 여성에게서 대부분 발병한다. 미국에서는 4,000명당 1명의 비율로, 남성보다는 여성에게서 더 많이 발생하며, 세계적으로는 약 5만 명 이상의 사람들이 루프스 질환을 가지고 있는 것으로 알려져 있다.
증상은 매우 다양하며, 루푸스 환자의 65% 정도는 특정 시기에 피부학적 증상을 보이고, 50% 정도는 질환과 관련하여 전형적인 나비 모양의 발진을 보인다. 루푸스 질환의 정확한 원인과 단일 유전자는 아직 밝혀져 있지 않으나 일반적으로 유전학적 요인과 환경적 요인, 약물 반응 등이 질환을 일으키는 것으로 알려져 있으며, 6번 염색체 상의 다수의 유전자들에 의해 루푸스 질환 발병률이 증가 하는 것으로 보인다. Procainamide, Hydralazine, Quinidine 등 약 400여개의 약물 치료법이 사용되고 있으나 현재 루푸스 질환을 완치 할 수 있는 치료법은 없는 실정이며, 일반적으로 코르티코스테로이드(Corticosteroid)와 면역 억제제(Immonusuppressants)를 사용하여 질환의 정도를 완화시키는 치료법이 사용되고 있다.
최근에는 루푸스 환자 치료법의 하나로 자가(Autologous) 줄기세포 이식술이 고려되고 있는데, 2006년 1월 Journal of the American Medical Association(JAMA)에 발표 된 연구 결과에 의하면 Northwestern Medical Hospital의 병세가 심한 48명 루푸스 환자에게서 긍정적인 결과를 보였다고 한다.
④ 겸형 세포 질환(Sickle Cell Disease)
겸형(낫 모양의, Sickle) 세포 질환은 겸형 헤모글로빈(Hemoglobin) - Hgb S 또는 Hb S -에 의한 유전 질환으로 알려져 있으며, 적혈구의 손상으로 인해 조직(Tissue)에서 산소(Oxygen)가 부족하게 되는 특징을 가진다.
겸형(낫 모양의, Sickle) 세포 질환은 겸형 헤모글로빈(Hemoglobin) - Hgb S 또는 Hb S -에 의한 유전 질환으로 알려져 있으며, 적혈구의 손상으로 인해 조직(Tissue)에서 산소(Oxygen)가 부족하게 되는 특징을 가진다.
겸형 세포 빈혈증(Sickle-cell anemia)의 경우 헤모글로빈의 β-글로빈(Globin) 사슬에서 점 돌연변이(Point mutation)가 일어나 β 사슬의 6번째 위치에 있는 글루탐산(Glutamic acid)이 발린(Valine)으로 치환되게 된다. 이로 인해 적혈구가 일그러지고 탄력성을 잃으며 겸형(Sickle, Scythe) 모양으로 바뀌게 되어 세포의 혈관 통과 능력에 영향을 받게 된다. 정상적인 적혈구의 경우 보통 도넛(Donut) 모양을 유지하는데 반해, 겸형 적혈구의 경우에는 낫 모양으로 인해 작은 혈관들을 잘 통과하지 못하면서 기관(Organ)과 조직의 산소 공급 혈액을 막는 장애물 역할을 하게 되고, 이것은 국소적 빈혈(Ischemia)과 경색(Infarction)으로 이어져 뇌졸중(Stroke)과 같은 기관 손상을 일으킬 수 있다. 또한 정상적인 적혈구의 경우 120일 정도 살지만, 겸형 적혈구는 약 10 ~ 20일정도 후에는 사멸하기 때문에 만성적인 적혈구 부족으로 인한 빈혈이 발생하게 된다.
겸형 세포 질환은 사하라 남부 아프리카, 남미, 쿠바, 중앙아메리카, 사우디아라비아, 인도, 터키, 그리스, 이탈리아 등의 조상을 가진 사람들에게서 특히 흔하게 발생하는 것으로 알려져 있다. 미국의 경우 약 72,000명 정도가 겸형 세포 질환을 가지고 있으며, 이들의 대부분은 아프리카로부터의 조상을 가지고 있는 것으로 추정된다. 아프리카계 미국인의 경우 출생 시 약 500명당 1명의 비율로 발생하며, 남미계 미국인의 경우 1,000명당 1명의 비율로 발생한다고 알려져 있다. 세계적으로는 약 백만 명의 사람들이 매해 겸형 세포 질환을 가지고 태어나는 것으로 보고되어 있다.
겸형 세포 이상을 가진 환자의 치료법으로는 인간 제대혈 줄기세포를 이용한 치료법이 수년간 성공적인 결과를 보이고 있으며, 형제자매의 제대혈 줄기세포를 겸형 세포 빈혈증을 가진 아이에게 성공적으로 이식한 사례가 2000년도 Journal of Pediatric Hematology and Oncology에 실린바 있다. 또한 2007년도 9월 ‘ViaCell'의 리포트에 의하면, Children's Hospital & Research Center Oakland에서 형제자매의 제대혈 줄기세포를 이용해 겸형 세포 질환 및 지중해 빈혈(Thalassemia)을 가진 어린이를 성공적으로 치료했다는 보고가 있었다.
골수(Bone marrow) 이식술 또한 겸형 세포 질환의 치료법으로 사용되고 있는데, 이는 유전적으로 적합한 공여자로부터 건강한 골수 및 줄기세포를 기증 받아 환자에게 이식함으로써 정상적인 헤모글로빈이 생산되게끔 하는 방법이다. 이러한 방법에 대한 임상 시험 결과에 따르면 이식받은 환자의 85%정도가 질환이 치료되는 성공적인 결과를 보였다. 그러나 이식을 위한 여러 조건들에 부합하는 경우를 찾는 것이 쉽지 않고, 유아 및 소아의 경우 제대혈 이식술이 적합한 경우가 더 많으며, 일반적인 부작용을 포함해 이식 약물로 인한 사망 가능성과 같은 대숙주성 이식 편병(Graft-versus-Host Disease, GvHD)의 위험도가 골수 이식술에서 더 크다는 것이 문제점으로 인식되고 있다.
II. 줄기세포 관련 연구 동향
1. 줄기세포 생산 기술
줄기세포 생산 방법은 그 종류와 연구 또는 치료 목적에 따라 달라 질 수 있다.
1) 배아 줄기세포(Embryonic Stem Cell, ES cell)
제공된 배아(Embryo)로부터 배아 줄기세포를 생산하기 위해서는 in vitro 수정 과정을 거쳐야 하며, 잉여 배아의 경우에는 차후의 연구 목적을 위해 얼려 보관하게 된다. 일단 위와 같은 방법으로 배아 줄기세포주(ES cell line)를 확립하게 되면 이 세포주를 통해 추가적으로 세포들을 얻을 수 있게 되는데 이러한 방법의 경우 배아 자체로부터 직접적으로 줄기세포를 분리 할 필요가 없기 때문에 법적, 윤리적인 문제점을 피할 수 있다.
이렇게 연구 목적으로 승인된 줄기세포주는 1990년대 후반까지 거슬러 올라가 Wisconsin-Madison 대학의 첫 인간 배아 줄기세포주에서 기원을 찾을 수 있으나, 연구자들은 이 세포주들에 대한 다음과 같은 몇 가지 문제점들을 지적하고 있다.
■ 적은 수의 줄기세포주는 유전적 다양성을 제한시켜, 특정 질병이나 특정 집단에만 이용 가능하다.
■ 세포주가 계대 배양됨에 따라 노화되면서 계대 초기만큼 잘 성장하지 못한다.
■ 세포주들은 성장 과정에서 비인간(Nonhuman) 세포들에 의해 오염될 수 있어 안전성 문제를 일
■ 세포주가 계대 배양됨에 따라 노화되면서 계대 초기만큼 잘 성장하지 못한다.
■ 세포주들은 성장 과정에서 비인간(Nonhuman) 세포들에 의해 오염될 수 있어 안전성 문제를 일
으킬 수 있다.
■ 일부 세포들의 DNA는 시간이 흐름에 따라 변화 될 수 있어 인체 또는 딸세포(Daughter cell)에 유
■ 일부 세포들의 DNA는 시간이 흐름에 따라 변화 될 수 있어 인체 또는 딸세포(Daughter cell)에 유
전적 결함이 이어질 수 있다.
(1) 치료용 복제(Therapeutic Cloning) 방법
치료용 복제 또는 체세포 핵이식(Somatic Cell Nuclear Transfer, SCNT) 기술은 수정란을 이용하지 않고 배아 줄기세포를 만들기 위해 고안된 기술이다.
일반적인 핵이식 과정은 공여핵세포(Donor somatic cell)와 수핵난자(Recipient Oocyte)의 접합을 통하여 이루어지며, 수정란의 할구 및 배수체를 갖는 성체·태아의 체세포가 공여핵으로 이용되고 있다. 체세포 핵이식 기술은 체세포를 공여핵으로 이용하는 핵이식 기술을 의미하며, 공여핵은 성체 혹은 태아 조직에서 얻게 된다. 체세포 핵이식 기술에 관한 개념적인 모식도는 다음 그림과 같으며, 그 내용은 다음과 같이 몇 단계로 나누어 설명할 수 있다.
<체세포핵이식 기술 모식도>
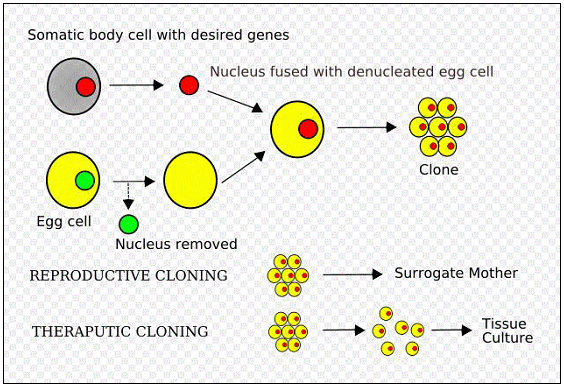
(출처 : Wikimedia Commons)
① 난자핵의 제거
공여핵을 이식할 수핵란은 체외에서 인위적으로 성숙·배양을 거쳐 체세포 접합 전에 핵을 제거한다. 이를 탈핵 과정이라고 한다.
공여핵을 이식할 수핵란은 체외에서 인위적으로 성숙·배양을 거쳐 체세포 접합 전에 핵을 제거한다. 이를 탈핵 과정이라고 한다.
② 체세포의 핵(Nucleus) 주입
체세포의 핵 이식은 탈핵 된 난자의 위란강(Perivitelline space) 또는 난자의 세포질 내에 체세포를 주입함으로서 이루어진다.
체세포의 핵 이식은 탈핵 된 난자의 위란강(Perivitelline space) 또는 난자의 세포질 내에 체세포를 주입함으로서 이루어진다.
③ 체세포 핵 및 탈핵란의 융합
체세포의 핵을 탈핵란에 주입한 후 전기적 자극을 통하여 물리적으로 융합시키는데, 이후의 난자를 체세포 복제 수정란이라고 부른다.
체세포의 핵을 탈핵란에 주입한 후 전기적 자극을 통하여 물리적으로 융합시키는데, 이후의 난자를 체세포 복제 수정란이라고 부른다.
④ 복제 수정란의 활성화 및 배양
전기 자극 또는 화학 물질에 의해 복제 수정란의 활성화를 유도하며, 이 과정을 통하여 복제 수정란의 정상적인 발생 과정이 진행되게 된다. 이와 관련 된 일련의 과정을 복제 수정란의 재프로그래밍(Reprogramming) 과정이라고 하며, 복제 수정란의 정상적 발생에 가장 중요한 요소 중 하나이다.
전기 자극 또는 화학 물질에 의해 복제 수정란의 활성화를 유도하며, 이 과정을 통하여 복제 수정란의 정상적인 발생 과정이 진행되게 된다. 이와 관련 된 일련의 과정을 복제 수정란의 재프로그래밍(Reprogramming) 과정이라고 하며, 복제 수정란의 정상적 발생에 가장 중요한 요소 중 하나이다.
치료용 복제는 1996년 돌리(Dolly)로 알려진 양(Sheep) 복제에서처럼 동물에서 일부 성공적인 결과를 냈으며, 2007년에는 Shoukhrat Mitalipov에 의해 체세포 핵이식 기술을 통한 영장류 줄기세포주 확립이 보고 된 바 있다.
치료용 복제를 목적으로 한 체세포 핵이식(Somatic Cell Nuclear Transfer, SCNT) 기술을 이용하면 환자 체세포 유래 배반포(Blastocyst)에서 배아 줄기세포주를 확립할 수 있으며, 이렇게 수립된 배아 줄기세포로부터 치료에 필수적인 세포를 분화 시킬 경우, 환자의 면역 거부 반응을 피할 수 있다는 장점이 있기 때문에 임상적 이용 가능성이 매우 높아지게 된다.
그러나 난자 세포와 삽입 되는 핵이 받게 되는 생물학적 스트레스가 매우 크다는 점으로 인해 진행 과정의 효율에 있어 매우 낮은 결과를 보이고 있는 것이 문제점으로 지적되고 있다. 한 예로 양(Sheep) 복제로 생산 된 돌리의 경우 복제를 위해 277개의 난자가 사용되었으며, 그 중 29개만이 살아있는 배아로 진행 되었고, 29개의 배아 중 3개만이 출생 때까지 살아남았으며, 그 중 돌리만이 최종적으로 성숙·발달하게 된 것이다.
2005년 한국의 황우석 교수 연구팀에 의해 체세포 핵이식 기술을 이용한 인간 배아 줄기세포의 복제 및 배양이 성공 했다는 보고가 있었으나 거짓으로 판정되었고, 미국의 경우 법적으로는 합법적이나 줄기세포 연구 분야에서 일반적으로 연구되고 있지는 않는 실정이라 인간에서의 치료용 복제는 이론적인 개념으로만 남아 있다.
(2) 미수정란(Unfertilized Eggs) 이용 방법
배아 줄기세포를 이용하는 대부분의 연구는 수정란으로부터 나오는 세포들을 이용하게 되지만, 2007년 7월, Lifeline Cell Technology의 연구자들에 의해 미수정란의 자극을 통한 인간 배아 줄기세포 형성이 성공 했다는 보고가 있었다. 그러나 미수정란을 통해 형성된 배아 줄기세포 역시 인간(Human)으로서의 가능성을 지닌 배아의 파괴로부터 얻어졌다는 점과 관련하여 윤리적인 문제에서 자유로울 수 없으며, 자연적으로 수정된 배아로부터의 배아 줄기세포만큼 효과적인지, 남성의 DNA 결손으로 인한 줄기세포 능력의 손상은 없는지 등에 대한 문제점과 의문점은 아직 남아있다.
배아 줄기세포를 이용하는 대부분의 연구는 수정란으로부터 나오는 세포들을 이용하게 되지만, 2007년 7월, Lifeline Cell Technology의 연구자들에 의해 미수정란의 자극을 통한 인간 배아 줄기세포 형성이 성공 했다는 보고가 있었다. 그러나 미수정란을 통해 형성된 배아 줄기세포 역시 인간(Human)으로서의 가능성을 지닌 배아의 파괴로부터 얻어졌다는 점과 관련하여 윤리적인 문제에서 자유로울 수 없으며, 자연적으로 수정된 배아로부터의 배아 줄기세포만큼 효과적인지, 남성의 DNA 결손으로 인한 줄기세포 능력의 손상은 없는지 등에 대한 문제점과 의문점은 아직 남아있다.
2) 성체 줄기세포 (Adult Stem Cell, AS)
다음과 같은 방법들이 성체 줄기세포를 분리하고 증식 시키는데 이용되고 있다.
(1) 백혈구 성분 채집술(Leukapheresis)
백혈구 성분 채집술(Leukapheresis)은 수혈을 위해 혈액에서 백혈구 세포들만을 분리하는 실험적 과정을 말한다. 이 과정을 통해 환자의 혈액 속에 있는 성체 줄기세포를 추출해 낼 수 있으며, 소요되는 시간은 보통 약 3 ~ 4시간정도이다. 추출 후 줄기세포는 동결 보존 과정을 거쳐 차후 환자에게 이식하게 된다.
(2) 말초 혈액(Peripheral Blood)
보통 정상적인 환경에서는 말초 혈액 내에서 줄기세포를 거의 볼 수 없으나, 특별한 약물을 사용하여 혈액에서 줄기세포를 유도하고 성분 채집술(Apheresis)을 통해 혈액에서 줄기세포를 분리할 수 있다. 성분 채집술 또는 자동 혈액 채집법(Automated Blood Collection, ABC)은 혈액 성분의 생산을 증가시키는 특화된 분리 과정으로, 2 ~ 3시간의 ABC 과정을 통해 혈액을 적혈구, 혈소판, 혈장 등으로 분리할 수 있다. 줄기세포를 포함한 필요 혈액 성분을 얻은 후에 나머지 성분들은 환자에게 돌려지게 되고, 줄기세포는 골수 이식을 위해 바로 사용되거나 액체 질소에 보관하게 된다.
현재는 줄기세포 성장 인자인 GM-CSF와 G-CSF의 사용 가능성이 알려지면서, 대부분의 조혈 줄기세포(Hematopoietic stem cell) 이식 과정에 있어 골수(Bone marrow)보다는 혈액으로부터 줄기세포를 분리하여 사용하고 있다. 과립구-대식세포 콜로니 자극 인자(Granulocyte-macrophage colony-stimulating factor, GM-CSF)는 면역계의 구성 성분으로서, 줄기세포로 하여금 과립성 백혈구(Granulocyte)와 단핵구(Monocyte)의 분비를 자극 시켜 감염 반응에 대응하게 하는 역할을 하며, 과립구 콜로니 자극 인자(Granulocyte colony-stimulating factor, G-CSF)는 골수에서 과립성 백혈구와 줄기세포의 생산을 촉진하는 역할을 한다. 또한 과립구-대식세포 콜로니 자극 인자(G-CSF)는 특정 암 환자에서 화학 요법 치료 후 회복 촉진에도 사용되며, 조혈 줄기세포 이식을 위한 백혈구 성분 채집술(Leukapheresis) 과정에서 혈액 내 조혈 줄기세포의 수를 증가시키는데도 사용되고 있다.
3) 제대혈 줄기세포 (Cord Blood Stem Cell)
제대혈은 통상적으로 제대혈 은행에서 제공하는 혈액 채집 키트를 이용해 태아가 태어나자마자 채집하게 되며, 은행으로 보내져 차후 보관 및 시험에 이용된다.
2. 역분화 만능 줄기세포(Reprogrammed Pluripotent Stem Cell)
역분화 만능 줄기세포란 만능분화능력(Pluripotency)을 가지고 있지 않던 분화된 세포들이 인위적인 역분화 과정을 통해 만능분화능력을 가지도록 유도된 세포들을 말하며, 유도만능줄기세포(induced Pluripotent Stem Cell, iPS)라고도 한다. 이 세포들은 배반포 (Blastocyst)에서 유래한 배아 줄기세포(Embryonic Stem cell, ES)와 비교해 볼 때 다음과 같은 유사성 및 장점을 가지고 있다.

그러나 유도만능줄기세포에 대한 연구는 최근에야 이루어져 왔기 때문에 이 세포들이 진정한 배아줄기세포의 대체가 될 수 있는지에 대해서는 충분한 검증이 이루어지지 않은 상태이며, 차후 연구 결과를 지켜봐야 할 것으로 보인다.
1) 역분화 개념
역분화(Dedifferentiation) 현상은 조직(Tissue)이 손상을 입었을 때 이미 존재하는 분화된 세포들이 초기의 미분화 상태로 되돌아간 후 새로운 분화 조직을 형성하는 현상을 말하며, 보통 왕성한 재생 능력을 지닌 도마뱀과 같은 하등 생물에서 이런 현상을 관찰 할 수 있었다. 역분화 현상은 세포 유전체의 후생학적인 변형(Epigenetic changes)들이 고정되어 있는 것이 아니라, 지워졌다 다시 형성 될 수 있는 가역적 (Reversible)인 과정이기 때문에 가능한 것으로 생각되고 있으며, 이러한 일련의 역행과정을 ‘Reprogramming'이라고 표현할 수 있다.
1996년 영국 Roslin Institute의 Ian Wilmut 박사팀이 성공 시킨 복제 양(Sheep) 돌리(Dolly)의 경우를 통해 이러한 역분화 현상에 대해 난자(Oocyte)에 존재하고 있는 인자들에 의해서 인위적으로 조절이 가능하다는 것이 처음 밝혀지게 되었다. 즉, 돌리 복제의 성공은, 핵(Nucleus)이 제거된 난자 안에 존재하고 있던 역분화 유도 인자들에 의해 새로 삽입된 분화 유선(Mammary gland) 세포의 핵 내 유전체가 미분화 상태로 되돌려졌음을 의미한다는 것이다.
2) 연구 결과 및 동향
돌리(Dolly) 복제 이후 2005년 Havard 대학 Eggan 박사 연구팀과 Collas 연구 그룹의 연구에 의해 난자뿐만 아니라 배아 줄기세포 내에도 역분화 유도 인자들이 존재한다는 것이 알려지게 되었으며, 이후 2006년 8월 일본 Kyoto 대학의 Shinya Yamanaka 박사 연구팀에 의해 체세포(Somatic cell)의 인위적 Reprogramming 유도 방법에 대한 논문이 ‘Cell’ 誌에 발표 되게 된다. 이 논문은 마우스(Mouse)의 간(Liver)과 위(Stomach) 세포를 이용하여 역분화 만능 줄기세포를 만드는데 성공함으로써 어떤 장기(Organ)의 세포도 역분화 될 수 있다는 가능성을 제시해 주고 있다.
Shinya Yamanaka 박사 연구팀의 연구 결과를 자세히 살펴보면, 연구팀은 배아 줄기세포의 특성을 유지하는데 관여할 만한 24개의 유전자들을 선정한 후, 배아 줄기세포에 특이적으로 발현하는 Fbx15 유전자의 프로모터(Promoter) 뒤에 β-Galactosidase와 Neomycin 내성 유전자를 삽입한 Knock-in 마우스로부터 배아 섬유아세포(Mouse Embryonic Fibroblast, MEF) 세포를 배양하여 24개의 후보 유전자들을 Retrovirus를 이용해 전달하여 역분화 유도에 관여하는 유전자를 스크리닝 하였다. 그 결과 c-Myc, Oct4, Sox2, Klf4와 같은 4 종류의 유전자를 전달 한 경우에 있어서 G418 내성을 가진 Colony가 생성되었고, 이 Cololny 세포들을 역분화 만능 줄기세포(iPS cell)이라고 명명하게 되었으며, 분석 결과 유전자의 발현 양상, 배아 줄기세포 마커(Marker) 발현, 기형종(Teratoma) 형성 능력 및 만능분화능력(Pluripotency) 보유, 세포 배양 시 Embryoid body(EB) 형성 등 여러 측면에서 배아 줄기세포와 유사한 특징들을 나타내었다.
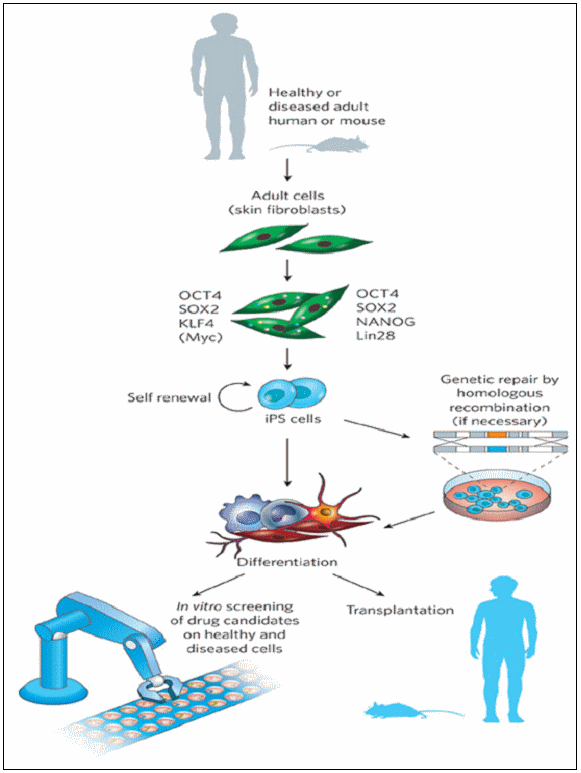
(출처 : R Passier, et al, Nature 453, 322(2008))
이후 2007년에 일본의 Yamanaka 연구팀, 미국 Jaenisch 연구팀, Havard 의대의 Hochedlinger 연구팀들도 매우 유사한 연구 결과를 발표하면서 Shinya Yamanaka 박사 연구팀의 4개의 역분화 유도 유전자들에 의한 Reprogramming 기술 재현성을 확인하였으며, 추가적으로 Shinya Yamanaka 박사 연구팀이 사용했던 Fbx15 프로모터 이용 방법보다 Oct4 또는 Nanog 유전자 프로모터를 이용한 Selection 시스템이 더욱 완전한 역분화 만능 세포를 얻을 수 있는데 유용하다는 사실을 밝혀내었다.
이와 같은 2006년의 마우스(Mouse) 체세포(Somatic cell)를 이용한 역분화 만능 줄기세포 성공 이후, Shinya Yamanaka 연구팀과 미국의 Thomson 연구팀은 일 년 뒤인 2007년에는 인간(Human) 세포를 이용하여 역분화 만능 줄기세포를 만들 수 있다는 연구 결과를 발표하게 된다.
이것은 곧, 환자와 동일한 유전자를 가진 세포를 대량으로 생산할 수 있음을 시사 한 결과로서, Yamanaka 연구팀은 마우스(Mouse) 세포의 역분화에 사용했던 4가지의 유전자를 Retrovirus를 이용해 성인의 피부유래 섬유아세포(Adult dermal fibroblast), 섬유아세포 유사 활막세포(Fibroblast-like synoviocyte), 그리고 신생아 섬유아세포(Neonatal fibroblast)로부터 확립된 세포주에 발현 시켰고, 그 결과 역분화 만능 줄기세포를 만들 수 있었다.
또한 1998년에 인간 배아 줄기세포를 처음으로 분리한 미국 Wisconsin 대학의 James Thomson 그룹은 Retrovirus 대신 렌티바이러스(Lentivirus)를 사용하여, Oct4 와 Sox2 유전자 이외에 Nanog 와 Lin28 등 4개의 유전자를, CD45+세포와 IMR90 태아유래 섬유아세포, 그리고 신생아의 표피 섬유아세포(Foreskin fibroblast) 내에 발현시킴으로써 역분화 만능 줄기세포를 얻을 수 있었다.
현재까지의 실험 결과들을 종합해보면 역분화 만능 줄기세포를 생성하는 과정에 있어서 Oct4와 Sox2 유전자가 필수적인 역할을 하며, 그 외의 인자들에 의해서 세포 상황에 따른 역분화 효율이 결정되는 것으로 보인다. 따라서 아직 밝혀지지 않은 역분화 유도 인자들 또한 상당수가 있을 것으로 예상되며 역분화의 스위치(Switch) 역할을 하는 핵심 유전자 또한 존재할 가능성도 예상 해 볼 수 있다. 이러한 사실들은 효율적인 역분화 만능 줄기세포 생성 방법을 개발할 여지가 많다는 것을 의미하며, 향후 이 부분들에 대한 철저한 연구가 필요할 것으로 생각된다.
2009년 3월에 개최된 ‘일본 재생 의료 학회’에서는 일본 동경대 의과학연구소의 Nakauchi 교수 연구팀이 혈액으로부터 역분화 만능 줄기세포를 만드는데 성공했다는 결과가 발표된 바 있는데, 사람의 역분화 만능 줄기세포는 주로 피부로부터 조직을 분리해 만들지만 피부 세포는 바늘을 사용해 채취하기 때문에 출혈성 혈액 질환 환자나 아이에게 있어서는 적합하지 않은 경우가 있을 수 있다. 따라서 Nakauchi 교수 연구팀의 혈액을 통한 역분화 만능 줄기세포 제작 가능 결과는 손쉽게 세포를 분리 할 수 있고, 환자와 의사 모두에게 부담이 줄어들 수 있다는 점에서 재생 의료의 실현이 한층 더 가능해 진 것으로 평가받고 있다.
또한 2009년 3월 27일자로 미국 과학 잡지인 ‘Science’ 誌의 온라인판 속보(Science Express)를 통해, 미국 Wisconsin 대학의 James Thomson 그룹이 기존의 역분화 만능 줄기세포를 제작하는 방법에서 외래 유전자를 도입하는 과정에 종래의 바이러스 유래 벡터(Vector)가 아닌 플라스미드(Plasmid)를 이용했다는 결과가 보고되었다. 이 연구 결과에 따르면 비바이러스성(Non-viral) 벡터인 비삽입성 에피솜 벡터(Non-integrating episomal vector)를 이용하여 사람의 역분화 만능 줄기세포를 만드는데 성공하였으며, 외부로부터 인공적으로 삽입시킨 유전자를 완전히 제거하는 것에도 성공했다고 한다. 최초에 제작된 사람의 역분화 만능 줄기세포는 바이러스성 벡터를 이용하여 4종류의 필수 유전자를 체세포에 도입해 제작하였으나 이럴 경우 바이러스에 의한 부작용 위험이 있을 수 있고, 삽입된 4 종류의 유전자가 예상치 못한 이상(Abnormal) 반응을 일으킬 수도 있다는 위험성을 내포하고 있다. 따라서 이 연구 성과는 재생 의료에 사용이 가능한, 보다 안전한 역분화 만능 줄기세포의 제작을 향한 개량법으로서 의미가 있을 수 있다.
3) 질병 모델
역분화 만능 줄기세포의 장점들 중 하나는 질병 모델 제작을 통한 약물 스크리닝(Screening)과 환자 면역 적합 형 세포치료제 개발이라고 할 수 있다.
최근 개인 맞춤형 치료제의 개발에 있어 그 가능성을 보여주는 결과가 미국 MIT의 Jaenisch 연구팀에 의해 보고된 바 있는데, 연구 결과에 따르면 Jaenisch 연구팀은 인간의 글로빈(Globin) 유전자로 치환된 인간화(Humanized) 마우스의 겸상적혈구 빈혈증 모델 (hbS/hbS)의 꼬리로부터 얻은 섬유아세포 내에 Oct4, Sox2, Klf4, c-Myc 유전자들을 레트로바이러스로 전달, 발현시켜 역분화 만능 줄기세포를 만든 후, 이 역분화 만능 줄기세포를 상동성 재조합(Homologous recombination)에 의한 유전자 Targeting 방법으로 hbA/hbS 유전자형을 가지도록 변형시켰다. 그리고 조혈모세포(Hematopoietic progenitor cell)들로 분화시켜 다시 겸상적혈구 빈혈증을 가진 마우스에 이식함으로써 정상적인 적혈구가 생성되도록 하는데 성공하였다고 한다(Cell Stem Cell 2: 10-12, 2008). 이 결과는 자신의 세포를 이용하여 역분화 만능 줄기세포를 만들고 유전자를 교정한 후 분화시켜 이식함으로써 면역 거부 반응 없이 유전 질환을 치료할 수 있다는 가능성을 처음 보여주었다는 점에서 그 의미를 찾을 수 있다.
또한 2008년 2월에는 Keio 대학의 Okano 교수 연구팀에 의해 척추 손상에 의해 뒷다리가 마비된 마우스에서, 손상 후 9일 째에 역분화 만능 줄기세포에서 분화시킨 신경전구세포(Neural progenitor cell)를 이식시킨 결과 체중을 버틸 수 있을 정도까지 회복이 되었고, 종양은 생기지 않았다는 결과가 발표 된 바 있어 역분화 만능 줄기세포의 개발 이후, 향후 역분화 만능 줄기세포를 이용한 세포 치료법에 관한 연구는 가속화 될 것으로 전망된다.
4) 문제점
인간 배아 줄기세포(Embryonic stem cell)를 비롯해 역분화 만능 줄기세포가 공통적으로 가지고 있는 문제점은 분화 후 이식(Transplantation)에 있어서 발생 가능한 기형종(Teratoma) 생성 문제라고 할 수 있으며, 역분화 만능 줄기세포를 처음으로 개발한 Shinya Yamanaka 박사 연구팀의 보고에 의하면 마우스의 역분화 만능 줄기세포로부터 유래한 자손(Offspring)의 20% 정도가 암(Cancer)을 형성 하였다고 한다.
이러한 결과는 다음과 같은 원인들에 의한 가능성으로 생각되고 있는데, 첫째, 역분화 만능 줄기세포를 유도하는 유전자들 중에 c-Myc과 Klf4와 같은 유전자들은 기존에 암 발생과 관련하여 c-Myc 단백질의 경우 여러 종류의 암을 유발하고, p53-dependent 세포자연사(Apoptosis)를 유발하는 것으로 알려져 있다. 따라서 이 유전자가 염색체(Chromosome)로 삽입 된 뒤 불발현화(Silencing)의 상태로 존재하다가 나중에 어떤 자극에 의해서든 다시 활성화되어 발현함으로써 암이 유발 될 수 있다는 것이다. 또한 Klf4는 암 억제 유전자인 p53을 억제하면서 c-Myc에 의해 유도되는 apoptosis도 억제하는 것으로 알려져 있으며, p21(Cyclin-dependent kinase inhibitor 1A, Cip1)을 활성화 시켜 세포 증식을 억제하는 기능도 가지고 있는 것으로 알려져 있다. c-Myc 단백질은 p21을 억제함으로써 Klf4의 세포 증식 효과를 낮추는 역할을 하기 때문에 결국 c-Myc과 Klf4의 균형이 역분화 만능 줄기세포의 암 발생에 중요한 영향을 주는 것으로 생각되고 있다.
두 번째 가능성은 세포의 종류에 따라 차이가 있을 수 있지만 마우스 배아 섬유아세포(Mouse Embryo Fibroblast, MEF)의 경우, 각 유전자를 발현하는 레트로바이러스는 염색체 안으로 보통 5 ~ 8개의 위치에 삽입되는데, 모두 4 종류의 레트로바이러스를 사용하다보니 그 과정에서 적어도 염색체 내에 20 ~ 30개의 위치에 삽입이 될 것으로 예상 할 수 있다. 이럴 경우 염색체 상에 존재하는 암 발생 억제에 관여하는 유전자(Tumor suppressor gene)들이나 세포의 기능에 중요한 역할을 하는 유전자들의 가운데에 삽입이 되어 그 기능이 상실되면 암 유발 또는 그 외 심각한 문제들이 일어 날 수 있다는 것이다.
결국 역분화 만능 줄기세포를 인간에게 세포 치료제로 사용하기 위해서는 안전성 문제를 극복해야 하며 향후 기대될 수 있는 해결 방법은 다음과 같이 정리 해 볼 수 있다.
■ 역분화를 유도하는 소분자 화합물(Small molecules)을 스크리닝 & 발굴
■ 유전자 대신에 단백질을 만들어 세포 내로 전달하는 방법을 사용
■ 염색체에 끼어들어가지 않는 비삽입성 에피솜 벡터(Non-integrating episomal vector)를 이용
■ 물리적 또는 환경적 자극으로 역분화 유도가 가능한 다양한 기술의 개발
■ 유전자 대신에 단백질을 만들어 세포 내로 전달하는 방법을 사용
■ 염색체에 끼어들어가지 않는 비삽입성 에피솜 벡터(Non-integrating episomal vector)를 이용
■ 물리적 또는 환경적 자극으로 역분화 유도가 가능한 다양한 기술의 개발
위 방법 중 비삽입성 에피솜 벡터(Non-integrating episomal vector)를 이용하는 방법은 미국 Wisconsin 대학의 James Thomson 그룹에 의해 2009년 3월 27일자로 ‘Science’ 誌의 온라인판 속보(Science Express)를 통해 발표된바 있다.
또한 2009년 5월 28일에는 국내 차병원그룹 연구진에 의해 세계 최초로 임상 적용이 가능한 '역분화 만능 줄기세포'를 만드는데 성공했다는 결과가 ‘Cell Stem Cell’ 誌에 게재되었는데, 이는 환자 체세포로 확립한 줄기세포의 임상적용 시 문제가 됐던 안전성 문제를 해결한 것으로 평가받고 있다.
<역분화 줄기세포 확립 모식도>
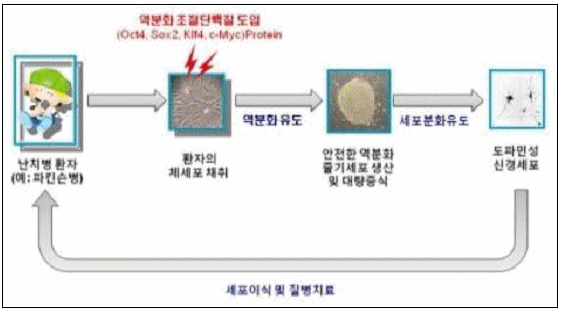
(출처 : 차병원그룹)
차병원 통합 줄기세포 치료 연구소장인 하버드대 김광수 교수와 바이오기업인 차바이오앤디오스텍(CHA Bio & Diostech)의 자회사 스템인터내셔널(StemInternationl) 연구팀의 연구 결과에 의하면 기존의 역분화 만능 줄기세포 생산은 역분화를 조절하는 유전자를 발현하는 바이러스나 발암성 화학물질을 이용해왔기 때문에 연구 목적으로 사용 할 수밖에 없는 제한점이 있었으나, 김광수 교수팀은 역분화 조절 단백질만으로 체세포를 줄기세포로 전환하는 기술을 개발하여 역분화 줄기세포의 임상 적용 시 한계로 작용했던 안전성 문제를 해결했다는 것이다.
또한 2006년 처음 알려진 이후 안전성과는 별개로 역분화 만능 줄기세포가 얼마나 뛰어난 분화 능력을 지녔는지에 대해서도 많은 관심이 있어왔는데, 최근 중국 과학자들에 의해 역분화 만능 줄기세포로 생쥐 개체들이 만들어짐으로써, 역분화 만능 줄기세포가 배아 줄기세포와 마찬가지로 모든 장기와 조직으로 분화하는 능력을 지니고 있음이 입증되었다.
중국 Beijing의 the Institute of Zoology의 Qi Zhou 연구팀과 the National Institute of Biological Sciences의 Shaorong Gao 연구팀은 각각 생쥐의 성체 세포인 섬유아세포에다 역분화를 유발하는 유전자들을 삽입해 역분화 만능 줄기세포를 만든 뒤, 이를 태반(Placenta)으로만 성장하게 조절시킨 다른 생쥐 배아(Embryo)에다 집어넣어 생쥐 개체로 성장시키는데 성공했으며, 이후 생쥐 개체들은 대리모 생쥐들을 통해 태어났다고, 각각 연구 결과를 7월 23일자 'Nature' 誌와 ‘Cell Stem Cell’ 誌에 동시 발표했다.
특히 'Nature' 誌에 발표된 the Institute of Zoology 연구팀의 결과에 따르면 역분화 만능 줄기세포로 복제한 결과, 624개의 유전자가 삽입된 배아(Embryo) 중에서 27마리의 살아있는 마우스를 얻을 수 있었으며, 약 3.5%의 성공률을 보였다고 한다. 이들은 교배 과정을 거쳐 새끼(Offspring)까지 생산하였으며, 3세대(Generation)까지 이어지는 과정에서도 이상(Abnormality)이 보이지 않아 안전성에 문제가 없다고 발표하였다.
이번 실험 결과는 분화 능력에서 최고로 꼽히는 배아 줄기세포와 거의 동등한 분화 능력이 역분화 만능 줄기세포에서도 확인됐다는 점에서는 의미가 있지만 역분화 만능 줄기세포의 최대 난제인 안전성 문제가 해결된 것은 아니며, 세포 분화 메커니즘에서는 여전히 모르는 사실들이 많기 때문에 줄기세포의 본래 연구 목적인 세포 치료와 임상 적용의 측면에서만 볼 경우 크게 의미 있는 결과는 아니라는 의견도 제기되고 있다. 또한 생명 윤리적 논란에서 벗어나 있던 역분화 만능 줄기세포가 배아와 결합할 때 개체 복제로 이어질 수도 있다는 사실로 인해 윤리적 문제가 불거질 가능성도 제기되고 있다.
3. 국내 연구개발 동향
▣ 배아줄기세포
⊙ 차바이오앤디오스텍(CHA Bio & Diostech)
1) 사업 조직

2) 사업 전략 및 현황
바이오 분야에서 한국은 기술 종속국이 될 가능성이 크기 때문에 원천 기술 개발도 중요하지만 사업화에 보다 더 집중한다는 전략을 가지고 있다.
(1) 줄기세포 연구·개발

□ 서울CRO
* 차바이오&디오스텍과 일본의 임상시험 기업 도쿄 CRO, 의약품 및 의료기기 인허가 컨설팅 업체인
메디헬프라인이 합작해 세운 법인
* 임상시험 위탁 수행 및 국내 최초 SMO(Site Management Organization) 서비스-임상시험 수행
기관인 병원을 지원하는 사업-도 제공할 예정
*서울 CRO를 통해 기초연구부터 개발, 임상, 상품화까지 전 과정을 실현할 수 있는 토털 원스톱 시
스템을 갖추고, 이를 통해 줄기세포 임상적용을 앞당기고 해외시장 진출의 기반을 마련하는데 주력
할 예정
□ 국제 줄기세포 메디클러스터
*성남시와 경기도 성남시 분당구 야탑동 일원에 ‘국제 줄기세포 메디클러스터’ 설립을 위한 MOU
*성남시와 경기도 성남시 분당구 야탑동 일원에 ‘국제 줄기세포 메디클러스터’ 설립을 위한 MOU
(양해각서)를 체결
* 분당차병원에 인접한 분당경찰서 및 보건소 부지에 총 면적 160,535m2 규모의 ‘국제줄기세포 메디
클러스터’를 설립할 계획
* ‘국제줄기세포 메디클러스터’에는 국제 줄기세포 치료병원, 국제 줄기세포 임상시험센터, 줄기세
포 통합연구센터, 산학협력센터, 전문 인력 양성센터, 입주지원시설이 입주할 예정이며, 현재 서울
역삼동에 있는 차병원그룹 6개 줄기세포 관련 연구소도 모두 이전할 계획
□ 역분화줄기세포 확립 성공
* 차병원 통합줄기세포치료연구소의 김광수 소장과 바이오 기업 차바이오앤디오스텍의 자회사
Stem Cell & Regenerative Medicine International (Stem International) 연구팀은 세계 최초로
역분화 조절 단백질만을 이용한 역분화 만능 줄기세포 확립기술을 공동으로 개발하는데 성공
* 역분화 조절 단백질만으로 체세포를 줄기세포로 전환하는 기술을 개발함으로써 역분화 만능 줄기
세포의 임상적용에 있어 한계로 작용했던 안전성 문제를 일시에 해결
* 이번 개발된 기술을 바탕으로 의학적으로 안전한 맞춤형 역분화 만능 줄기세포 은행을 구축하는
것이 가능해졌으며, 이를 통해 차병원그룹이 보유하고 있는 망막상피세포, 인공혈액, 심혈관세포
등의 각종 줄기세포 분화기술에 접목하여 세포치료제 개발을 진행할 방침
(2) 안티에이징(Anti-aging)
□ 차디폼(CHAdiform) : 차바이오앤디오스텍이 독자적으로 개발하였으며, 인체의 복부나 허벅지 등
에서 지방을 뽑은 후 나중에 지방세포가 될 순수한 줄기세포만을 추출, 꺼진 볼살 등에 주입함으로
써 볼륨감 있는 얼굴이나 몸매를 만드는 성형시스템. 2009년 출시
□ 에버셀(Evercell) : 미국 ACT사로부터 원천기술 도입 후 제품화에 성공. 항노화 기능성 화장품으
로써 줄기세포 배양액으로부터 세포성장 인자 등을 추출한 후 피부에 미세한 구멍을 뚫고 투입시
키면 주름이 펴지고 피부 미백·보습 효과를 볼 수 있음. 2009년 출시
(3) 실버케어(Silver care)
□ 차실버케어센터
2009년 5월 분당차병원에 재가노인요양복지기관인 ‘차실버케어 분당센터’ 개소(開所). 차실버케어는 국내 최초의 대형 병원을 모기업으로 하는 전문요양서비스 기관으로서, 차병원의 의료 인프라를 기반으로 노인 장기 요양 보험 수급대상자에게 방문요양과 방문목욕, 방문간호 서비스 등과 같은 차별화된 전문 요양 서비스를 실시 예정
⊙ 제일약품 : 파킨슨병과 관련한 배아 줄기세포 연구
1) 계열사 및 관계사
(1) 한국 오츠카 제약
(2) 한국 다이이찌산쿄

(3) 제일기린

2) 사업 전략 및 현황
연구소 내의 신약 연구실은 의약 합성팀과 약효 검색팀, 줄기세포 연구팀으로 구성되어 있으며, 줄기세포 연구팀을 통해 파킨슨병과 같은 만성질환 및 난치성 질환의 치료제를 개발한다는 전략
(1) 줄기세포 연구·개발
□ 파킨슨병 치료제 개발
* 서울대 의대, 연대 의대와 공동 연구 결과 2008년에 연세대 김동욱 교수와 제일약품 조명수 박사팀
에 의해 인간 배아 줄기세포로부터 세계 최고 순도(86%)의 도파민 신경세포를 대량으로 생산하는
기술이 개발됨
* 전 세계적으로 도파민 세포 수율은 60~70%대에 머물렀음
* 도파민 세포는 파킨슨 질환 치료에 사용할 수 있으며, 연구팀은 파킨슨 마우스 모델에 이 세포를
이식해 안전성과 유효성을 확인하였고 현재 임상시험 진입을 준비 중
□ 뇌·신경계 질환 연구센터
* 2009년 6월 보건복지가족부 지정 뇌신경계 질환 중개연구센터로 한양대학교병원 신경과가 선정됨
* 2009년 6월 보건복지가족부 지정 뇌신경계 질환 중개연구센터로 한양대학교병원 신경과가 선정됨
* 뇌·신경계 질환 중개 연구 센터는 알츠하이머병, 치매, 루게릭병 등의 노인성 뇌·신경계 질환에 대
한 연구센터로 향후 4년간 신경계 퇴행성질환의 신규 치료제 개발, 치매 및 루게릭병 임상시험의
승인획득 등을 진행
* 뇌·신경계 질환 중개 연구 센터의 주관은 신경과(김승현 교수팀)에서 맡게 됐으며 신약 개발 및 분
석 부분은 제일약품과 공동 연구
* 임상연구는 서울의대 신경과(이광우, 홍윤호 교수팀)와 약물독성분은 대구한의대 구세광 교수팀
이 함께 참여
* 이번 센터 운영은 그동안 신경과학교실에서 수행해오던 신규나노입자를 이용한 줄기세포 치료 후
생체 내 추적 장치 개발 및 평가사업, 새로운 분자생물학적 표적을 이용한 난치성 신경계 질환 치
료제 개발사업 등과 연계하게 됨
(2) 공장 이전
□ 오송 생명과학단지 투자 계획 백지화
* 수도권 규제 완화 정책으로 인해 1천400억 원을 투자해 신 공장을 짓기로 했던 제일약품은 충북 지
역 투자 유치를 유보하면서 입주를 포기하고 기존의 경기도 용인 공장을 증설 계획
□ 강원도 원주 기업도시 투자 계획
* 춘천에 미국 바텔연구소(ISS사)의 유치 확정 및 미국 스크립스의 한국스크립스 설립 결정
* 2020년까지 원주 기업도시는 의료산업 및 연구개발 지식기반형 기업도시인 메디폴리스를 건립한
* 춘천에 미국 바텔연구소(ISS사)의 유치 확정 및 미국 스크립스의 한국스크립스 설립 결정
* 2020년까지 원주 기업도시는 의료산업 및 연구개발 지식기반형 기업도시인 메디폴리스를 건립한
다는 계획에 따라 제일약품도 2009년 4월 투자협약 체결
* 참고 : 원주기업도시 개요

⊙ 삼진제약 : 인간배아줄기세포를 이용한 장기 손상 및 퇴행성 질환 치료
1) 사업 조직
경기도 화성 시에 제약공장 위치
2) 사업 전략 및 현황
인간 배아줄기세포를 미분화된 상태로 배양하여, 인간 배아줄기세포의 분화 초기 단계인 배양체(Embryoid body)를 다량 제작할 수 있는 방법을 개발하고, 이를 통해 미분화된 인간 배아줄기세포로부터 특정 세포로의 분화과정을 개발해, 향후 특정 분화세포를 대량으로 생산하여 장기손상 및 퇴행성질환 치료 목표
□ 당뇨 및 폐질환 세포 치료제 개발
* 과학기술부의 21C 프론티어 연구개발 사업 중 세포응용연구과제로 삼진제약의 줄기세포 연구가
* 과학기술부의 21C 프론티어 연구개발 사업 중 세포응용연구과제로 삼진제약의 줄기세포 연구가
선정됨
* '인간 배아줄기세포로부터 췌장 β 세포로의 분화 유도 기술 개발'이란 주제로 진행되었으며 연구
를 통해 미분화된 인간 배아줄기세포로부터 내배엽세포로의 분화 유도 방법을 개발하는 것을 목
적으로 하고 있음
* 간, 허파 및 위장관을 구성하는 세포로의 분화를 통해 당뇨병을 비롯한 간질환이나 폐질환을 치료
하는 세포치료제로서의 역할을 수행할 수 있을 것으로 예상
* 삼진제약 중앙연구소 세포응용연구개발팀 박용빈 박사를 주축으로 2004년 ~ 2008년 3월까지 진
행되었음
▣ 성체줄기세포
⊙ 세원셀론텍 : 자가 유래 연골 세포치료제 콘드론 출시
1) 사업 전략 및 분야
세원셀론텍은 기존 사업-플랜트, 유압-에서 발생하는 자금을 기반으로 연골세포치료제 등 바이오사업에 투자하고 있어 상대적으로 자금력에서 우수하다는 평가를 받고 있으며, 기존 플랜트사업이 2008년 기준 매출의 88%, 영업 이익의 96%를 차지하고 있음
- 세원셀론텍 바이오솔루션 사업부문
(1) Cell Therapy : 인체조직을 재생하는 세포의 피드백 메커니즘을 활용한 개인맞춤형 세포치료제
□ 콘드론(Cartilage RMP)
* 2001년 국내 최초로 바이오 기술을 이용한 자가 유래 연골 세포치료제 ‘콘드론’ 출시
*자신의 건강한 연골을 분리·배양한 후 손상된 연골부위에 이식하기 위한 개인 맞춤형 연골 세포치
료제
* 적응증 : 연골 손상
* 효능 : 연골 재생
* 적응증 : 연골 손상
* 효능 : 연골 재생
□ 오스론(Bone RMP)
* 2003년 성인 골수로부터 뼈세포를 증식 분화하여 제조한 ‘오스론’을 출시하여 세계 최초로 ‘자가
유래 뼈세포치료제’의 상업화 성공
* 자신의 건강한 뼈세포를 분리·배양한 후 뼈 손상 부위에 다시 이식하는 개인맞춤형 뼈세포치료제
* 적응증 : 골절, 골괴사
* 효능 : 뼈의 재생
* 자신의 건강한 뼈세포를 분리·배양한 후 뼈 손상 부위에 다시 이식하는 개인맞춤형 뼈세포치료제
* 적응증 : 골절, 골괴사
* 효능 : 뼈의 재생
□ 베이비셀(Cord Blood Preservation)
* 제대혈 보관은행은 ‘베이비셀5C 프로그램’이라는 제대혈 보관 시스템을 운영하며, 2003년 제대혈
* 제대혈 보관은행은 ‘베이비셀5C 프로그램’이라는 제대혈 보관 시스템을 운영하며, 2003년 제대혈
보관은행 분야에서는 국내 최초로 ISO9001인증
*여러 가지 난치성 질환의 치료에 대비하여 조혈모세포가 풍부한 아기의 제대혈을 분리·보관하기
*여러 가지 난치성 질환의 치료에 대비하여 조혈모세포가 풍부한 아기의 제대혈을 분리·보관하기
위한 시스템
□ 더만(Skin RMP)
* 자가 유래 자가 피부 세포를 이용하여 상처, 화상 등의 피부손상부위에 이식하는 피부재생치료제
*적응증 : 피부손상, 화상, 외상
* 효능 : 피부의 재생
* 자가 유래 자가 피부 세포를 이용하여 상처, 화상 등의 피부손상부위에 이식하는 피부재생치료제
*적응증 : 피부손상, 화상, 외상
* 효능 : 피부의 재생
□ 아디폼(Fat RMP)
*자가 지방세포를 순수지방으로 분리하여 미용 및 성형이 필요한 곳에 주입하기 위한 자가 유래 지
방재생치료제
* 적응증 : 주름, 가슴성형
* 효능 : 안전성 및 개선 효과 지속시간 증가
* 적응증 : 주름, 가슴성형
* 효능 : 안전성 및 개선 효과 지속시간 증가
(2) Bio Collagen : 상처의 치유, 미용목적의 피부 복원 및 성형, 약물전달체계(DDS)를 위해 나노 테
크놀로지가 적용된 고순도 콜라겐 제품
□ 바이오 콜라겐(Bio Collagen)
* 고순도 생체적합성 아텔로콜라겐 원료
□ 테라필(Therafill)
* 조직 복구를 위한 고순도 아텔로콜라겐 필러
□ 테라폼(Theraform)
* 조직 재생 유도와 상처 치유를 위한 스펀지 형태의 아텔로콜라겐 바이오드레싱제제
□ 노보스트라타(Novostrata)
* 피부재생용 고보습 아텔로콜라겐 화장품
□ 바이오스트라타(Biostrata)
* 아텔로콜라겐과 TDS 기술을 이용한 경피용 연고제제
(3) Platform : 세포재생기술 및 줄기세포 보관기술을 바탕으로 전 세계 병원에서 GMP 기준에 적
합하게 세포 처리 및 공정을 수행할 수 있도록 바이오설비, Operating system, 원부자재, 공정 및
품질관리를 패키지로 제공
2) 사업 현황
* 뼈세포치료제 오스론은 다중 적응증(뼈골절, 골괴사, 뼈유실, 치조골 약화 등)에 대한 허가를
* 뼈세포치료제 오스론은 다중 적응증(뼈골절, 골괴사, 뼈유실, 치조골 약화 등)에 대한 허가를
2009년 2월에 식약청 신청
* 오스론은 정형외과의 다양한 분야에 사용될 것으로 보이며 단기적으로는 치과분야의 임플란트 시
* 오스론은 정형외과의 다양한 분야에 사용될 것으로 보이며 단기적으로는 치과분야의 임플란트 시
술 단축효과가 있을 것이며, 노인의 치조골 강화에 따른 임플란트 시술 능력제고, 풍치의 개선 등
에 대한 시장 잠재력이 높을 것으로 전망
* 바이오콜라겐을 활용한 테라폼(의료용 소재), 테라필(필러)도 오는 4분기 중 상용화될 가능성이
* 바이오콜라겐을 활용한 테라폼(의료용 소재), 테라필(필러)도 오는 4분기 중 상용화될 가능성이
높다는 평가. 자체개발 인체 적합성 바이오콜라겐을 소재로 한 테라폼(의료용 소재 : 상처보호, 수
술용, 치과용)은 2009년 4월에 미국의 식품의약국(FDA)에 품목허가를 신청한 상태로 오는 9월 또
는 10월 중에 시판허가를 받을 것으로 전망
⊙ 알앤엘바이오 : 지방줄기세포치료제 연관 기업
1) 사업 전략 및 분야
(주)알앤엘바이오는 줄기세포 연구 기술과 천연물 스크리닝 기술을 보유하고 있으며, 줄기세포를 이용한 세포 치료제 및 천연물 신약 개발을 목표로 함. 서울대 수의과대학 교수들을 주축으로 공학, 의학 등 분야의 전문가들로 구성된 산학협동 네트워크가 구축되어 있음
(1) 줄기세포 분야
서울대학교 수의과대학 강경선 교수팀과 함께 탯줄 혈액과 지방조직 등에서 줄기세포를 분리, 배양
서울대학교 수의과대학 강경선 교수팀과 함께 탯줄 혈액과 지방조직 등에서 줄기세포를 분리, 배양
및 분화 유도하여 난치병 치료를 위한 줄기세포 세포 치료제 개발
□ 줄기세포 보관 사업
□ 줄기세포 화장품
□ 반려동물 줄기세포 보관 및 복제
□ 줄기세포 화장품
□ 반려동물 줄기세포 보관 및 복제
(2) 내분비 분야
당뇨병 치료에 탁월한 천연물 신약 개발 및 성장촉진, 다이어트에 효과적인 천연소재를 개발하여 상
당뇨병 치료에 탁월한 천연물 신약 개발 및 성장촉진, 다이어트에 효과적인 천연소재를 개발하여 상
품화
(3) 생물안전 분야
매실, 키토산 등을 주성분으로 하여 인체 및 동물에도 안전한 식품소재 천연 소독제 제품화를 시작으
매실, 키토산 등을 주성분으로 하여 인체 및 동물에도 안전한 식품소재 천연 소독제 제품화를 시작으
로, 항균 및 항바이러스 효과가 뛰어난 상귀나린의 식물세포 대량배양에 성공, 천연물로부터 각종 바
이러스에 대한 직접적인 바이러스 차단 작용을 보이는 천연 항바이러스 신약을 개발
2) 현황
□ 해외 환자 대상 성체 줄기세포 메디투어 사업
* 세계 최대의 가톨릭 온라인 포털업체인 TGE와 협약 체결로 인해 특히 미국과 유럽으로부터 줄기
* 세계 최대의 가톨릭 온라인 포털업체인 TGE와 협약 체결로 인해 특히 미국과 유럽으로부터 줄기
세포 보관 및 치료고객 유치 가능
* 미국 EMMI와의 협력 하에 미국 내 1,000개 병원을 한국으로의 줄기세포 보관 및 치료를 위한 협력
* 미국 EMMI와의 협력 하에 미국 내 1,000개 병원을 한국으로의 줄기세포 보관 및 치료를 위한 협력
병원으로 지정하여 향후 1년 내에 미국에서만 최소 5,000명의 고객을 확보할 수 있을 것으로 전망
□ 척수손상 환자 대상 임상
* 사람의 척수손상을 치료하는 성체 줄기세포 치료제 ‘알앤엘-아스트로스템’에 대한 상업임상에 대
* 사람의 척수손상을 치료하는 성체 줄기세포 치료제 ‘알앤엘-아스트로스템’에 대한 상업임상에 대
한 IRB심의를 완료하고 2009년 7월 샘안양병원과 임상시험 연구 용역 계약 체결
□ 줄기세포 은행 사업의 세계화
*사람에서의 성체 줄기세포 치료효과의 신뢰도 향상에 따라 국내 고객뿐만 아니라 미국, 일본, 중국
*사람에서의 성체 줄기세포 치료효과의 신뢰도 향상에 따라 국내 고객뿐만 아니라 미국, 일본, 중국
등 10개국으로 확대되어 하반기에는 더욱 고객수가 급증할 것으로 예상
*국내에서의 상용화가 이루어질 경우 해외로부터 한국으로의 줄기세포 메디컬투어가 급성장할 것
*국내에서의 상용화가 이루어질 경우 해외로부터 한국으로의 줄기세포 메디컬투어가 급성장할 것
으로 예상
□ 세계적 재생의학병원 구축
* 알앤엘바이오 대표 겸 경남 양산에 소재하는 베데스다 삼성병원 이사장으로 취임한 라정찬 대표
* 알앤엘바이오 대표 겸 경남 양산에 소재하는 베데스다 삼성병원 이사장으로 취임한 라정찬 대표
는 2009년 7월 13일 개최한 베데스다삼성병원 비전 선포식에서 "베데스다삼성병원이 성체줄기세
포로 노인성질환과 난치병환자에게 재생치료를 할 수 있도록 재활의학과를 신설해 명실상부한 전
문 재 생 의학 병원으로 육성하겠다"고 밝히고 "또 알앤엘바이오와 협력해 일본ㆍ중국 환자들이
찾는 해 외 메디컬투어사업의 허브로 삼겠다"고 발표
* 베네스다삼성병원과의 협력으로 병원 내 IRB를 구성하여 성체 줄기세포의 응급임상과 연구자 임
상을 적극 실시할 계획이며 재활의학과, 신장내과, 피부과의 신설을 통해 일본, 중국 등 해외 환자
들의 메디투어사업을 적극 추진할 예정
* 알앤엘바이오는 중국 북경, 연길에도 줄기세포 치료 병원을 운영 중이며, 일본으로도 줄기세포 네
* 알앤엘바이오는 중국 북경, 연길에도 줄기세포 치료 병원을 운영 중이며, 일본으로도 줄기세포 네
트워크를 확장하고 있음
* 참고 : 베네스다 삼성 병원은 내과, 외과, 정형외과, 신경외과, 산업의학과, 소아과, 마취과 등 8개
과로 구성되어 있으며 300병상 규모
⊙ 메디포스트 : 제대혈, 성체 줄기세포 연골치료제 카티스템 등 임상 중
1) 사업 전략 및 분야
미래 맞춤 의학 개발에 중요한 제대혈 내의 다양한 줄기세포를 이용한 세포대치요법(Cell Replacement Therapy) 개발을 위해 서울대병원, 삼성서울병원, 서울아산병원 등의 생명공학분야 권위자들이 설립한 생명공학기업
□ 국내 최고의 의료 전문 인력 및 기술진/장비
□ 국내 대표성을 갖는 중앙 제대혈 데이터 센터 설립 및 관련단체의 후원
□ 국내 대표성을 갖는 중앙 제대혈 데이터 센터 설립 및 관련단체의 후원
*삼성의료원 제대혈 은행, 부산경남지역 제대혈 은행과 함께 KCBBN(Korean Cord Blood Bank
Network) 결성
* 한국조혈모세포은행협회, 대한조혈모세포이식학회, 대한임상병리학회, 대한수혈학회 등 관련 단
* 한국조혈모세포은행협회, 대한조혈모세포이식학회, 대한임상병리학회, 대한수혈학회 등 관련 단
체와 협력체계 구축
(1) 생명공학연구소
□ 연구1부(조혈모세포 연구실)
*제대혈 세포 은행 개발 완료 - 제대혈 이식 다수 수행
* 조혈모세포-간엽 줄기세포 병합 치료제 개발 중
□ 연구2부(비조혈모세포 연구실)
* 간엽 줄기세포 은행 개발완료
* 제대혈 유래 연골 재생 세포 치료제 개발 중
* 제대혈 유래 뼈재생 세포 치료제 개발 중
* 심장·근육 세포 재생 세포치료제 개발 중
* 신경 세포 재생 세포 치료제 개발 중
□ 개발부
* 구로동 대륭 포스트타워 2차내에 370평 규모의 세포 치료제 공장 위치
* 줄기세포 치료제 IND 및 NDA
* 줄기세포 치료제 임상시험
* 줄기세포 치료제 제조 및 품질관리
* 연골 손상 치료를 위한 줄기세포 치료제(CartistemTM) 임상 승인(1,2상 진행 중)
2) 현황
□ 2009년 6월 ‘제대혈 관리법 제정안' 발의-박근혜 의원-
*제대혈은 관련 바이오 기업과 일부 지방자치단체에서 제대혈 은행을 운영하면서 제대혈 위탁 및
*제대혈은 관련 바이오 기업과 일부 지방자치단체에서 제대혈 은행을 운영하면서 제대혈 위탁 및
기증을 맡아왔으나, 명확한 법적 근거가 없이 복지부 가이드라인에 의존해 왔음
*국내에는 18여개의 제대혈 은행에 30만여 건의 제대혈을 보관중인 상태로 2005년 기준 메디포스트
가 45%, 차바이오텍 13%, 보령바이오파마 6% 등의 점유율을 보이고 있는 상태
⊙ 이노셀 : 제대혈 업체군(항암 면역세포치료, 제대혈 보관, 항암치료진단)
1) 사업 분야 및 현황
면역세포 치료제 개발을 통한 항암 세포 치료 전문기업 목표
□ 면역세포치료제
* 이뮨셀-엘씨 : 2007년 KFDA 판매허가 획득, 현재 간암, 뇌종양에 대한 임상 3상 시험 진행 중
□ 면역세포 은행
* 건강한 상태 또는 암 진단을 받았으나 면역기능을 저하시키는 여러 가지 치료를 받기 전에 다량의
림프구를 채집하여 냉동보관함으로써 추후 항암 면역세포 치료가 필요할 때 양질의 면역세포 치
료제로 사용 가능
□ EDR(Extreme Drug Resistance) 검사
* 일종의 항암제 저항성 검사로서, 환자 개인의 종양을 수술 또는 생검(Biopsy)을 통하여 얻은 다음
항암제에 대한 저항성을 미리 검사하여 항암제 처방에 있어 비효과적인 항암제를 선별하여 치료제
선택에서 제외시킴으로써 치료 성적을 높일 수 있도록 개발된 검사법
□ 제대혈 은행
▣ 기타
⊙ CJ제일제당 제약사업본부
□ 줄기세포 연구 전문기업인 ‘뉴랄스템(Neuralstem)’에 투자 계약체결
* 2008년 2월 아시아에서의 독점 사업 라이선스 보장을 조건으로 미국 줄기세포 연구 전문기업인
‘뉴랄스템(Neuralstem)’에 250만 달러를 투자하는 계약을 체결
* 뉴랄스템은 척수손상, 루게릭병 등 중추신경계 치료용 세포치료제 개발에 특화돼 있는 연구전문
* 뉴랄스템은 척수손상, 루게릭병 등 중추신경계 치료용 세포치료제 개발에 특화돼 있는 연구전문
기업
* 2013년 첫 치료제품을 출시할 계획이며, CJ제일제당은 아시아 6개국(한국, 싱가포르, 필리핀, 베
* 2013년 첫 치료제품을 출시할 계획이며, CJ제일제당은 아시아 6개국(한국, 싱가포르, 필리핀, 베
트남, 인도네시아, 말레이시아)에 대한 독점 사업 라이선스를 보장
* 본부 내에 줄기세포 관련 투자전담 TF팀 운용 및 CJ창업투자를 통한 줄기세포 투자전문 펀드도
* 본부 내에 줄기세포 관련 투자전담 TF팀 운용 및 CJ창업투자를 통한 줄기세포 투자전문 펀드도
설립
□ '서울시 제대혈 줄기세포 응용사업단' 합류
* 2009년 2월 서울특별시와 서울대학교 수의학과 연구진이 진행하는 '서울시 제대혈 줄기세포 응용
* 2009년 2월 서울특별시와 서울대학교 수의학과 연구진이 진행하는 '서울시 제대혈 줄기세포 응용
업단'에 합류 결정
* '줄기세포 응용사업'은 서울시가 전략산업 혁신 클러스터 육성 지원사업의 하나로 진행하는 사업
이며, 서울대 수의학과 강경선 교수를 단장으로 2006년부터 5개년 계획으로 사업을 진행 중
* CJ제일제당은 4년차인 올해 2009년부터 사업에 참여해 연간 5억 원씩 직접 투자 계획
* '줄기세포 응용사업단'은 이번 연구를 통해 골 결손 질환과 퇴행성 뇌질환, 허혈성 난치 질환 치료
제 개발을 위한 주요 기술 확보를 기대하고 있는데, 이 중 CJ제일제당은 퇴행성 뇌질환, 허혈성 난
치질환 치료 기술에 대한 글로벌 우선 실시권을 확보하게 됨
* 글로벌 우선 실시권은 특허권을 갖고 있는 서울대로부터 기술에 대한 판매·수출·응용 개발에 대한
권한을 보장 받는 것으로 이를 통해 CJ제일제당은 2013년경 이후 기술수출을 통한 로열티 수입이
나 세포치료제의 직접 생산이 가능하고, JV(Joint Venture)형태로 사업을 전개하는 등 실용화 단계
에서 다양한 비즈니스 모델을 적용할 수 있음
⊙ 제주대 박세필 교수팀/미래생명공학연구소/중앙바이오텍
□ ‘역분화 만능 줄기세포(iPS)'
* 난자를 쓰지 않고 사람의 피부세포로 역분화 만능 줄기세포를 만드는 방법이 세계에서 세 번째로
국내에서 개발
* 제주대 줄기세포연구센터와 미래생명공학연구소(소장 김은영)의 박세필 교수팀은 건국대 조상구
* 제주대 줄기세포연구센터와 미래생명공학연구소(소장 김은영)의 박세필 교수팀은 건국대 조상구
교수팀과 공동으로 2008년 6월 피부세포로 220여 가지의 인간 장기 세포로 증식 가능한 ‘역분화 만
능 줄기세포(iPS)'를 만드는데 성공하여, 국내외에 특허를 출원
□ 중앙 바이오텍
* 2007년 중앙 바이오텍은 줄기세포 전문 연구소인 미래 생명공학 연구소(대표 박세필)에 10억
* 2007년 중앙 바이오텍은 줄기세포 전문 연구소인 미래 생명공학 연구소(대표 박세필)에 10억
5200만원을 투자, 지분 29.9%를 보유한 2대 주주가 됨
* 중앙 바이오텍은 미래 생명공학 연구소가 출원하는 특허 기술사용관 및 제품의 상품화 등 포괄적
부분에 대해 절반의 권리를 갖게 됨
* 미래 생명공학 연구소는 다량의 줄기세포를 확보하고 이를 치료를 위한 특정 세포로 분화를 유도
하는 기술을 보유한 연구소로 박세필 대표는 중앙 바이오텍 연구소 연구소장(비상근)을 겸직해 연
구 성과와 상품화에 최대한 협력할 예정
⊙ 서울대병원 심혈관센터 조헌재·김효수 교수팀
□ 안전성 높인 역분화 만능 줄기세포 제조기술 개발
*2008년 9월 난자 없이 피부세포만으로 `맞춤형 다기능줄기세포(역분화 만능 줄기세포)'를 만들 수
*2008년 9월 난자 없이 피부세포만으로 `맞춤형 다기능줄기세포(역분화 만능 줄기세포)'를 만들 수
있는 새로운 방법을 생쥐 실험을 통해 찾았다고 발표
* 조현재 교수팀이 개발한 기술의 차이점은 앞서 역분화 만능 줄기세포를 만드는데 성공한 연구팀들
과 달리 줄기세포 확립 과정에서 인체에 유해할 수도 있는 바이러스 운반체(Vector)를 사용하지
않은 점. 즉 기존의 연구팀들이 피부 세포를 역분화 만능 줄기세포로 변환시킬 때 특정 유전자를
레트로바이러스에 실어 세포 속으로 주입했지만 조현재 교수팀은 이 과정을 없애고 대신 특정 단
백질 처리만으로 같은 효과를 낼 수 있도록 했다는 것
* 난자 없이 역분화 만능 줄기세포를 만드는 과정에서 안전성에 문제가 있는 바이러스를 사용하지
않고, 단백질을 이용함으로써 안전성 문제를 해결한 게 특징
⊙ 마리아병원/마리아 바이오텍
□ 마리아 바이오텍

* 마리아 바이오텍 대표 = 임진호 = 의료법인 마리아병원 원장
* 모기업인 마리아병원은 국내 최대 불임치료 전문병원으로, 마리아 바이오텍은 마리아병원의 전문
* 모기업인 마리아병원은 국내 최대 불임치료 전문병원으로, 마리아 바이오텍은 마리아병원의 전문
성을 토대로 배아줄기세포를 전문적으로 개발, 상업화 할 목적으로 설립
□ 마리아 병원
* 마리아병원은 불임치료 전문기관으로 유명. 불임치료만을 취급하는 곳은 마리아병원이 유일
* 서울 본원에 이어 국내에는 송내, 일산, 평촌, 대전, 대구, 부산, 제주에 분원이 있으며, 심신의학센
* 서울 본원에 이어 국내에는 송내, 일산, 평촌, 대전, 대구, 부산, 제주에 분원이 있으며, 심신의학센
터로 마리아플러스를 운영 중. 중국 심양과 북경에도 분원 개설
□ ‘냉동잔여배반포기배아’ 연구
* 90년대 초 미국 Wisconsin 대학의 James Thomson 교수 밑에서 배아 줄기세포를 연구한 박세
* 90년대 초 미국 Wisconsin 대학의 James Thomson 교수 밑에서 배아 줄기세포를 연구한 박세
필 박사를 영입
* 마리아생명공학연구소 박세필 박사팀이 2005년 10월 미국에서 특허를 획득한 ‘냉동잔여배반포
* 마리아생명공학연구소 박세필 박사팀이 2005년 10월 미국에서 특허를 획득한 ‘냉동잔여배반포
기 배아’ 연구는 배아줄기세포 연구에 있어 윤리적 논란을 최소화할 수 있는 방법
* 남녀 간에 정상적으로 수정된 배아를 이용함으로써 복제가 원천적으로 불가능
* 시험관 아기를 낳을 때 거치는 ‘과배란유도제’ 주사 후 얻어진 난자들은 보통 시험관에서 수정·배
* 남녀 간에 정상적으로 수정된 배아를 이용함으로써 복제가 원천적으로 불가능
* 시험관 아기를 낳을 때 거치는 ‘과배란유도제’ 주사 후 얻어진 난자들은 보통 시험관에서 수정·배
양된 뒤 배아가 되면 불임여성의 자궁에 투입됨. 이때 성공률은 30% 정도이기 때문에 의료진은
실패 할 경우를 대비해 여분의 배아를 냉동 보관하게 됨
⊙ 신여성병원
□ 체세포복제배아 연구기관 등록
* 신여성 불임센터는 2007년부터 보건복지부 시험관아기 시술센터로 지정되어 경기북부 최대 불임
센터 운영
* 의정부 신여성병원은 전국에서 7번째, 지방병원으로는 최초로 신여성병원 불임센터(이준범 박사)
* 의정부 신여성병원은 전국에서 7번째, 지방병원으로는 최초로 신여성병원 불임센터(이준범 박사)
가 체세포복제배아 연구기관에 등록되어 체세포복제배아를 생성하고 이를 이용하여 줄기세포주를
수립하는 등 체세포핵이식연구 행위가 가능
* 신여성병원외에 체세포복제 연구기관으로 등록된 곳은 서울 미즈메디병원, 차병원, 한양대병원,
* 신여성병원외에 체세포복제 연구기관으로 등록된 곳은 서울 미즈메디병원, 차병원, 한양대병원,
서울대 의과대학, 서울대병원, 수암생명공학연구원 등 6곳
* 연구에 사용되는 난자는 배아생성을 위해 동결 보존하는 폐기예정 난자 및 미성숙, 비정상인 폐기
* 연구에 사용되는 난자는 배아생성을 위해 동결 보존하는 폐기예정 난자 및 미성숙, 비정상인 폐기
예정인 난자, 체외수정시술에 사용된 폐기예정 난자, 불임치료를 목적으로 채취된 폐기예정인 난
자, 적출한 난소에서 채취한 난자 등 5가지
⊙ 황우석 박사/수암생명공학연구원/서울대 산학협력단
□ 황우석 박사/수암생명공학연구원
* 황우석 박사가 이끄는 수암생명공학연구원은 ‘1번 복제 인간배아줄기세포(NT-1)에 대한 특허를
* 황우석 박사가 이끄는 수암생명공학연구원은 ‘1번 복제 인간배아줄기세포(NT-1)에 대한 특허를
호주에서 최종 승인받을 것이라고 2008년 9월 발표
* NT-1은 황우석 박사가 Science지에 발표했던 복제 인간배아줄기세포 가운데 유일하게 실제로 존
* NT-1은 황우석 박사가 Science지에 발표했던 복제 인간배아줄기세포 가운데 유일하게 실제로 존
재하고 있는 것이지만 처녀생식인지 체세포복제 결과인지는 아직 공식적인 법원 판결이 나지 않았
음
* 2008년 12월에 열린 황우석 관련 30차 공판에서 충북대학교 정의배 교수가 증인으로 출석하여, 수
* 2008년 12월에 열린 황우석 관련 30차 공판에서 충북대학교 정의배 교수가 증인으로 출석하여, 수
암생명공학연구소에서 줄기세포 공여자 체세포 대조군을 확보한 상황에서 의뢰한 NT-1에 대한 재
검증 결과, 처녀생식이 아닌 체세포복제 판명이라는 결과가 나왔다고 진술한 바 있음
* 서울대 산학협력단 이미 서울대 조사위에서 아닌 걸로 판명됐고 이후로 추가 실험을 한 적도 없어
* 서울대 산학협력단 이미 서울대 조사위에서 아닌 걸로 판명됐고 이후로 추가 실험을 한 적도 없어
호주 특허청 자료를 줄 수 없다고 통보
* 호주 특허청(IP Australia)은 아직 특허를 승인하지 않았으며, 줄기세포에 대해 특허는 계속 심사
* 호주 특허청(IP Australia)은 아직 특허를 승인하지 않았으며, 줄기세포에 대해 특허는 계속 심사
중
⊙ 대학 산학협력단
2009년 4월경에 국회에 상정될 기술 지주회사 설립 규정인 ‘산업교육진흥 및 산학협력촉진에 관한 법률’ 개정안이 설립 기준 완화로 가닥을 잡은 것으로 알려져 대학 기술 지주회사 설립이 가속화될 것으로 전망
□ 서울대 산학협력단
*스너피 개 복제에 관한 특허권과 관련하여 (주)알앤엘바이오에 전용 실시권을 허용
* 2008년 7월에는 강원도 평창군과 대화면 신리 일원에 ‘서울대학교 그린바이오 첨단연구단지’ 조성·
*스너피 개 복제에 관한 특허권과 관련하여 (주)알앤엘바이오에 전용 실시권을 허용
* 2008년 7월에는 강원도 평창군과 대화면 신리 일원에 ‘서울대학교 그린바이오 첨단연구단지’ 조성·
운영을 위한 산학협력 계약을 체결
* ‘첨단연구단지’ 조성사업이 완료되는 2010년 이후에는 바이오 관련 기업들의 입주와 서울대의 연
* ‘첨단연구단지’ 조성사업이 완료되는 2010년 이후에는 바이오 관련 기업들의 입주와 서울대의 연
구 역량, 기업의 자본력을 바탕으로 630만 명에 달하는 고용효과와 239억 원의 직접적인 파급효과
를 예상
* 그린바이오 첨단연구단지는 서울대 농업생명과학대학이 주관하여 운영할 것으로 예정
* 그린바이오 첨단연구단지는 서울대 농업생명과학대학이 주관하여 운영할 것으로 예정
□ 동국대
* 동국대도 2008년 말 줄기세포치료제 R&D 기업인 휴림바이오셀과 산학협력 조인식을 갖고 아시
* 동국대도 2008년 말 줄기세포치료제 R&D 기업인 휴림바이오셀과 산학협력 조인식을 갖고 아시
아 최대 규모의 줄기세포 은행을 설립, 이를 기반으로 지주회사를 출범할 예정
* 동국대 산학협력단의 한 관계자는 “줄기세포 치료제와 전자태그(RFID) 관련 시스템 등 현재 보유
* 동국대 산학협력단의 한 관계자는 “줄기세포 치료제와 전자태그(RFID) 관련 시스템 등 현재 보유
하고 있는 기술 3∼4개를 검토 중이다”라며 “8월 경 기술 지주회사 공간이 확보 되는대로 출범할
예정”이라고 밝힘
□ 경희대
* 경희대는 300가지 이상의 제약관련제조 기술을 보유하고 있는 한방제약회사를 자회사로 둔 총 자
* 경희대는 300가지 이상의 제약관련제조 기술을 보유하고 있는 한방제약회사를 자회사로 둔 총 자
본금 5억 원 규모의 ‘경희기술지주회사(가칭)’를 출범 예정. 이달 말 교육과학기술부에 인가 신청서
를 낼 계획이며, 경희대 산학협력단이 지난해 설립한 한방제약회사 지분을 26% 이상 가지고 있으
며, 하반기에 경희대가 개발한 순수 기술을 기반으로 자회사를 만들어 본격 수익을 낼 것이라고 밝
힘
III. 줄기세포 시장
1. 주요 국가별 줄기세포 연구 지원 현황
1) 미국

2) 캐나다

3) 유럽

4) 영국

5) 이스라엘

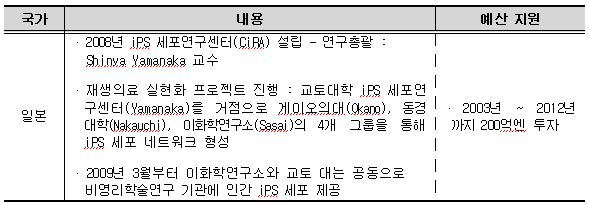
6) 일본
7) 싱가포르

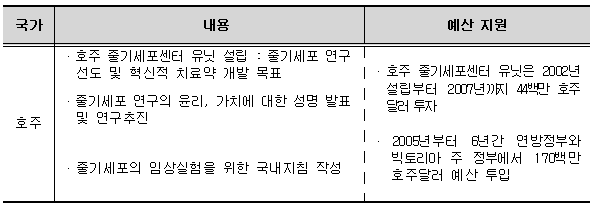
8) 호주
2. 시장 분석
현재 줄기세포 기술은 미국, 영국, 일본, 호주 등 선진국들 간 특정 세포 분화 유도 기술에 대한 기술 경쟁이 치열한 상황에서, 특히 시장 규모가 큰 난치성 질환 치료를 위한 신경세포, 심혈관 세포, 간(Liver) 세포, 췌장 세포 분화 유도 기술에 집중되고 있다.
현재 국내 기술은 배아 줄기세포의 확립 기술에 있어서는 상대적 우위에 있으나, 세포치료를 위한 실질적 핵심 기술인 특정 세포로의 분화 유도 기술에 대한 기술 경쟁력은 비교적 낮은 것으로 알려지고 있지만, 국내 기술은 미분화 인간 배아 줄기세포주 배양 기술 단계에서 분화 유도 기술 개발 단계로 전환하는 시점이라고 할 수 있으며, 세계적으로도 분화 유도율은 신경계 세포를 제외하고는 20 ~ 30% 미만에 불과하다.
2009년 3월에 발표된 삼성경제연구소 보고서에 따르면 세계 줄기세포 관련 시장은 2012년에 324억 달러에 달할 것으로 예상되고 있으며, 현재 다수의 임상 시험이 진행되고 있는 성체 줄기세포 분야가 180억 달러로 가장 큰 시장을 형성할 것으로 전망하고 있다. 배아 줄기세포 관련 분야도 임상 시험 및 치료적 임상 시장을 중심으로 2012년경에는 약 50억 달러 규모의 시장을 형성할 것으로 내다보았다.
기술 분야별로는 줄기세포의 이식 관련 시장 및 기초 연구용 시장을 중심으로 발전한다는 전망이 있었으며, Kalorama Information이 발표한 세포기원별 세포치료기술 전망을 통해 좀 더 자세히 살펴보면 자가이식의 경우 동종이식과 유사한 기술이 사용되나 면역문제 해결을 위한 별도의 조작이 필요하지 않아 향후에도 자가 이식이 세포 치료에 있어 주요 역할을 할 것이며 말초혈액과 체세포의 역할도 증대될 것으로 전망하였다. 동종 이식의 경우 면역 반응 문제로 인해 앞으로는 큰 역할을 하기 힘들 것으로 예상된다. 반면 골수 세포는 현재까지 주된 세포 치료제였으나 말초 혈액으로부터 줄기세포를 분리하는 기술 개발로 2015년까지 그 역할이 점차 감소할 것으로 예상하고 있다. 많은 가능성에도 불구하고 윤리와 안전성 논쟁에 있는 배아 줄기세포의 경우 2015년경에 상업화된 제품도 등장할 것으로 예상되었다.
<줄기세포 분야별 세계시장 현황 및 전망(2005년 ~ 2012년)>
(단위 : 백만 달러, %)
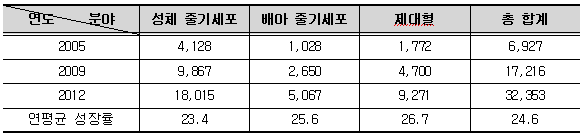
(출처 : 삼성경제연구소(2009), Research Impact Technologies(2008).Stem Cell Research-A Market Insight Report)
<세포기원별 세포 치료 기술 전망>
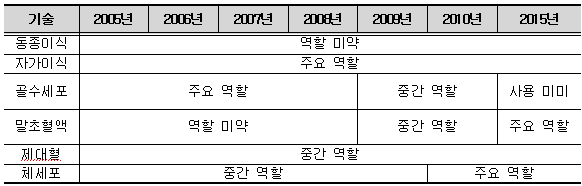
(출처 : Kalorama Information 2004, 한국보건산업진흥원)
IV. 전망
2009년 3월 9일, 미국의 오바마 대통령의 배아 줄기세포의 규제 완화 방침이 발표된 상황에서 미국은 이미 배아 줄기세포 분야에서 주도적 입장을 확보하고 있으며, 역분화 만능 줄기세포 연구에 관해서도 미국과 일본은 선두를 달리고 있다.
2009년 1월, 미국식품의약국(FDA)은 벤처기업인 Geron社에 인간 배아 줄기세포(human Embryonic Stem Cell, hESC)를 하반신마비(Paraplegia) 환자 8 ~ 10명에 적용하는, 세계 최초의 인간 배아 줄기세포 임상 시험을 승인하는가 하면, 글로벌 제약기업인 박스터(Baxter International)는 만성(Chronic) 심장병 환자에게 자신의 성체 줄기세포를 주사해 심장병을 치료하는 임상 시험 2단계를 진행 중에 있다.
영국의 줄기세포 연구 기업인 리뉴런그룹(ReNeuron Group)은 뇌졸중(Stroke) 환자에게 신경 재생이 가능한 배아 줄기세포를 뇌에 직접 투여하는 임상 시험 1단계를 2009년 6월부터 시행 중에 있으며, Fairfield 병원은 2007년 4월에 배아 줄기세포로 심장 일부를 배양하는데 성공한 이후 현재 동물실험을 거쳐 임상시험을 계획 중이다.
일본 역시 2006년 Kyoto 대학에서 역분화 만능 줄기세포를 처음 만들어낸 뒤 2007년 말 인간 역분화 만능 줄기세포를 미국 Wisconsin 대학의 James Thomson 그룹과 거의 동시에 세계 처음으로 개발하는 등, 줄기세포 연구에 박차를 가하고 있으며, 세계 선도 그룹에 있는 역분화 만능 줄기세포의 장점을 최대한 살리기 위해 대대적인 예산을 쏟아 붓고 있다. 2012년까지 200억 엔의 투자 계획이 잡혀 있으며, 일본 다이와 증권(Daiwa Securities Co., Ltd.)과 스미토모 미쓰이 은행(Sumitomo Mitsui Bank) 등 민간에서만 12억 엔을 투자해 역분화 만능 줄기세포 지적재산 관리 회사를 설립하기도 하였다. 이와 함께 미국 캘리포니아 재생의료연구소(California Institute for Regenerative Medicine, CIRM)와 연구 협정을 맺으며, 2008년 9월 Kyoto 대학은 미국 기업 Novocell과 제휴해 역분화 만능 줄기세포를 인간의 췌장세포에서 분화하는 연구를 하기로 하는 등 전 방위적으로 제휴협력을 위한 노력을 계속하고 있다.
한국의 경우 배아 줄기세포 연구보다는 성체 줄기세포 연구에 치중해왔으며, 주요 연구 업체로는 (주)알앤엘바이오가 지방 성체 줄기세포로 버거씨병(Burger’s disease) 치료제에 대해 임상 1, 2단계를 진행 중이며, 세원셀론텍은 골수 성체 줄기세포 치료제를 만들어 임상 3단계를 진행 중이고, 대량으로 제조하는 방법도 개발한 것으로 알려져 있다.
‘황우석 박사 논문 조작 사건’이 일어 난지 4년이 다 되어가는 상황에서 지난 4월 29일 정부는 대통령 직속 국가생명윤리심의위원회를 통해 3년 만에 차병원의 체세포복제 배아연구계획서에 대한 조건부 승인을 의결 한바 있다.
조건부 보완 사항으로는 첫째, 체세포 복제 배아 줄기세포 연구로 직접적·최종적인 치료목적을 달성할 수 없기 때문에 과도한 기대를 유발할 수 있는 연구제목을 수정하도록 하였으며, 둘째, 난자 제공자에 대한 동의서를 심의 과정에서 수정된 새로운 동의서로 동의 받도록 하였다. 셋째, 난자의 이용 개수를 기존 1,000개에서 800개로 줄여 과도한 난자 사용을 줄이도록 하였으며, 줄기세포주 1종 수립 시 연구를 일시 보류하고 국가위원회에 경과보고 후 연구 진행 여부를 결정하도록 하였다. 마지막으로, 기관생명윤리심의위원회(IRB)의 위원을 확대 보강하여 앞으로 연구진행과정에서 보다 객관적이고 균형 있는 자체 심의가 가능하도록 하였다.
이와 같은 국가생명윤리심의위원회의 조건부 승인은 ‘황우석 박사 논문 조작 사건’ 이후 중단되었던 한국의 체세포복제 배아 줄기세포 연구 개발의 공식적인 재개를 의미하며, 이와 같은 결정은 국가 성장 동력으로 자리매김할 수 있는 계기를 마련한 것으로 판단되고, 국내 제약 및 바이오 산업계에 있어 긍정적인 이슈로 생각되고 있다. 또한 사건의 전모와는 별개로 과거 사건을 기점으로 해 한국의 줄기세포 연구는 다양한 방법의 연구 기반을 다시 마련할 수 있었다는 평가를 내릴 수 있다.
교육과학기술부 21세기 프런티어연구사업인 세포응용연구사업단은 국제학술지 ‘Stem Cell’ 2007년 7월호에 게재된 통계를 인용해 인간 배아 줄기세포 논문 수에서 한국이 세계 4위를 차지했다고 발표한바 있으며, 최근에는 부산의대 강수경 교수팀, 연세대 김동욱 교수와 제일약품 조명수 박사팀 등의 연구 결과를 비롯해 차병원 통합줄기세포 치료연구소로부터 역분화 만능 줄기세포 연구에 관한 좋은 결과가 나오는 등 과거 한국의 줄기세포 연구는 황우석 박사식의 체세포 복제 배아 줄기세포밖에는 없다는 식의 국민적 인식에서 벗어나 다양한 줄기세포 및 연구 방법을 통해 발전을 하고 있는 것이다.
특히 최근 들어 관심이 집중되고 있는 역분화 만능 줄기세포 분야의 경우, 1996년 복제 양(Sheep) 돌리(Dolly)를 탄생시켰던 Roslin Institute의 Ian Wilmut 박사도 이제는 역분화 만능줄기세포 연구 분야에 전념할 것이라고 최근 공표를 한 바 있듯이 아직은 다른 분야에 비해 그 연구 역사가 짧지만 정부와 기업의 집중적인 지원 아래 연구자들의 역량을 집중한다면 한국에서도 좋은 결과를 낼 수 있는 분야이며, 역분화 만능 줄기세포는 이미 줄기세포 연구 분야의 한 축으로 자리 잡은 상태에서 그 중요성 또한 공감대를 형성하며 커져가고 있기 때문에 역분화 만능 줄기세포 분야에 대한 정부 차원에서의 신속하고 집중적인 지원과 함께 연구·개발에 있어 다음과 같은 점들을 생각해 볼 수 있다.
□ 표준화 및 기초적인 검증 토대 마련
현재의 역분화 만능 줄기세포 지식은 기초적인 연구지식 정도에서 역분화 만능 줄기세포를 정의하는 기준 또한 명확하게 정의되어 있지 않은 상태이다. 연구·개발 이후 실질적인 실용화를 위해서는 표준화 된 기준이 정의되어져야 하고, 그 표준화에 따라 기술 개발이 이루어져야 한다. 또한 역분화 만능 줄기세포를 제작하는 과정에 있어 만들어 질수 있는 분화 능력에 있어 차이가 나는 클론들을 검증하는 절차와 변화 조절 기작 등 기초적인 검증 시스템이 마련되어야 할 필요가 있다.
현재의 역분화 만능 줄기세포 지식은 기초적인 연구지식 정도에서 역분화 만능 줄기세포를 정의하는 기준 또한 명확하게 정의되어 있지 않은 상태이다. 연구·개발 이후 실질적인 실용화를 위해서는 표준화 된 기준이 정의되어져야 하고, 그 표준화에 따라 기술 개발이 이루어져야 한다. 또한 역분화 만능 줄기세포를 제작하는 과정에 있어 만들어 질수 있는 분화 능력에 있어 차이가 나는 클론들을 검증하는 절차와 변화 조절 기작 등 기초적인 검증 시스템이 마련되어야 할 필요가 있다.
□ 임상 지침
역분화 만능 줄기세포 연구는 이제 시작 단계에 있기는 하지만 재생의학을 비롯해 난치성 질환에 대한 치료 등에서도 임상적인 적용 가능성 및 기대감이 매우 높기 때문에, 차후 역분화 만능 줄기세포 분야에 있어 한국이 주도적 위치를 차지하기 위해서는 연구 시작 단계에서부터 임상 치료제로서의 가능성을 염두에 둔 연구기관·감독기관·산업계 차원에서의 연구·개발 시스템을 구축할 필요가 있다. 이를 위해서는 역분화 만능 줄기세포의 유효성과 안전성을 충분히 평가할 수 있는 시스템이 조속히 마련되어야 하고, 이러한 시스템 하에서 성과를 빠르게 이용할 수 있는 지침이 마련되어야 할 것이다.
역분화 만능 줄기세포 연구는 이제 시작 단계에 있기는 하지만 재생의학을 비롯해 난치성 질환에 대한 치료 등에서도 임상적인 적용 가능성 및 기대감이 매우 높기 때문에, 차후 역분화 만능 줄기세포 분야에 있어 한국이 주도적 위치를 차지하기 위해서는 연구 시작 단계에서부터 임상 치료제로서의 가능성을 염두에 둔 연구기관·감독기관·산업계 차원에서의 연구·개발 시스템을 구축할 필요가 있다. 이를 위해서는 역분화 만능 줄기세포의 유효성과 안전성을 충분히 평가할 수 있는 시스템이 조속히 마련되어야 하고, 이러한 시스템 하에서 성과를 빠르게 이용할 수 있는 지침이 마련되어야 할 것이다.
앞서 밝혔듯이 미국의 부시 정권 이후 오바마 정권에서의 줄기세포 연구에 대한 정책 전환을 통해 향후 역분화 만능 줄기세포를 포함해 줄기세포를 둘러싼 국가 간 경쟁은 더욱 치열해질 것으로 예상할 수 있으며, 줄기세포의 상업화를 앞당기기 위해 각종 연구 규제 완화 및 임상 시험 승인 등이 촉진될 것이라 전망 할 수 있다. 따라서 이를 통해 줄기세포 치료제가 현실화되고 일반화 될 경우 지금 현재의 제약 산업계 또한 구조적인 변화를 겪게 될 수 있다.
현재 제약 산업계는 글로벌 마케팅 망을 구축한 글로벌 메이저 제약사가 자체 생산 설비 또는 위탁 생산업체(Contract Manufacturing Organization, CRO)를 통해 시장을 장악하고 있는 중앙 집중화된 형태로 말할 수 있는데, 줄기세포치료제의 경우에는 소량의 줄기세포를 시술 직전에 배양하여 사용하거나, 환자의 세포를 채취해서 증식 후 환자에게 재 투여하는 방식이기 때문에 대량 생산 시설의 필요성이 상대적으로 낮아지게 돼서 생산 및 유통 체계에 있어 사용처 중심의 분산된 소규모 시스템으로 전환 될 가능성이 있다는 것이다. 따라서 규모면에서나 글로벌 마케팅 능력 면에서 상대적으로 취약하다는 평가를 받고 있는 국내 제약사 및 연구개발 기업에 있어서는 새로운 기회가 될 수 있는 것이기 때문에 대규모 생산설비와 유통망에 집중하기 보다는 향후 경쟁력을 부각시킬 수 있는 줄기세포의 분리, 분화, 조절과 같은 기술적 과정에 집중할 필요가 있다.
2009년 8월, 줄기세포분야 글로벌 선진국 5위 진입을 위한 국가 차원의 연구 활성화 전략이 발표되었다. 교육과학기술부가 확정한 ‘줄기세포연구 활성화 방안’을 통해 정부는 줄기세포 R&D 예산을 2009년 402억 원에서 2015년까지 1,200억 원으로 늘리면서 2015년에는 세계 5위권 내에 진입한다는 전략을 내놓은 것이다.
역분화 유도기술, 면역적합성 줄기세포 기술개발, 줄기세포 기반 신약개발 지원 및 약효ㆍ독성 검색기술, 줄기세포 기반 조직공학기술 등 줄기세포 관련 미래유망기술 R&D를 집중 지원해 글로벌 톱 수준의 연구팀 5개 이상을 확보, 성체 및 배아 줄기세포 이용 세포치료제 개발을 위한 실용화 및 임상기술 개발을 지원, `생명윤리 안전에 관한 법률‘에서 지정한 희귀 및 난치성 질환 치료 목적의 경우 배아연구가 보다 폭넓게 이뤄질 수 있도록 관련 지원을 확대, 검증된 줄기세포주의 안정적이고 효율적인 공급 체계를 갖추기 위해 국가 차원의 줄기세포 은행을 구축하고, 연구자들이 공동 활용할 수 있는 줄기세포 임상 및 생산인프라를 구축한다는 내용이다.
2005년 ‘황우석 박사 논문 조작 사건’ 이후 국내 줄기세포 연구는 침체되어 있었다고는 할 수 없겠지만 국민적인 공감대나 연구 지원 등에 있어서는 눈에 띄는 정책과 합의가 없었던 것은 사실이다. 줄기세포 연구를 위한 국내외적인 여건을 감안해 볼 때 최근 발표된 정부의 줄기세포 지원 정책은 그 맥락에서 다행스러운 일이라 할 수 있으며, 이제는 배아 및 성체 줄기세포, 역분화 줄기세포 등 다양한 기술 분야에 대해 집중적인 지원과 육성이 이루어져야 할 시점이라고 생각된다.
V. Company Profile

(출처 : Kalorama Information 재구성)

(출처 : Kalorama Information 재구성)
▣ Aastrom Biosciences [www.aastrom.com]
Aastrom Biosciences는 인체 조직의 치료 또는 재생을 위한 자가 이식(Autologous) 세포 치료제를 연구?개발하는 기업으로, 2007년 말 기준 250명 이상의 환자에게 자체 기술을 통한 임상 시험을 진행하였으며, 만성(Chronic) 질환과 뼈(Bone), 혈관, 심장, 신경 조직 등의 손상에 대한 치료제로서 자가 이식 세포를 이용하는 방법인 Tissue Repair Cell(TRC) 기술에 대해 특허 및 자체 기술을 보유하고 있다. 2007년 후반 기준, 대퇴골두(Femoral head)의 골괴사증(Osteonecrosis)에 있어 뼈 재생을 위한 치료제와 중증하지허혈(Critical Limb Ischemia) 질환에 있어 혈관 재생 치료제로 임상 3상을 진행하였으며, 신경(Neural) 및 심장(Cardiac)을 타깃으로 하는 전임상(Preclinical) 프로그램을 진행하고 있고, 대퇴골두의 골괴사증 및 확장성 심근병증(Dilated cardiomyopathy)에 대한 후보 물질을 Orphan 약물로 개발하고 있다.
▣ Advanced Cell Technologies [www.advancedcell.com]
Advanced Cell Technologies는 줄기세포 치료제의 개발 기업으로, 줄기세포 기술과 관련한 자체 기술 또는 라이선스에 대해 380개 이상의 특허를 보유하고 있다. Merk, GlaxoSmithKline, Pfizer, Roche 등과 같은 글로벌 제약 기업들과 전략적 제휴 관계를 형성하고 있으며, 현재 줄기세포 치료제와 관련한 다음과 같은 3개의 프로그램에 대해 집중적인 연구?개발을 진행 중이다. 근원세포(Myoblast) 프로그램은 2008년에 임상 2상을 시작하여 현재 진행 중이다
* 근원세포(Myoblast) 프로그램
* 망막 색소 상피(Retinal Pigment Epithelium, RPE)
* 혈액모세포 (Hemangioblast, HG) 프로그램
* 망막 색소 상피(Retinal Pigment Epithelium, RPE)
* 혈액모세포 (Hemangioblast, HG) 프로그램
▣ Brainstorm Cell Therapeutics [www.brainstorm-cell.com]
Brainstorm Cell Therapeutics는 골수(Bone marrow) 줄기세포로부터 Neural-like 세포로의 in vitro 분화(Differentiation)를 가능하게 하는 기술에 기반을 둔 치료제를 개발하는 기업으로, 골수의 인간 중간엽 줄기세포(Mesenchymal stem cell, MSC)를 내용으로 하는 'NurOwn' 플랫폼 기술을 확보하여 특허 출원중이다.
Brainstorm Cell Therapeutics는 골수(Bone marrow) 줄기세포로부터 Neural-like 세포로의 in vitro 분화(Differentiation)를 가능하게 하는 기술에 기반을 둔 치료제를 개발하는 기업으로, 골수의 인간 중간엽 줄기세포(Mesenchymal stem cell, MSC)를 내용으로 하는 'NurOwn' 플랫폼 기술을 확보하여 특허 출원중이다.
▣ Celegene [www.celgene.com]
1980년도에 설립되었으며, 암(Cancer), 면역-염증(Immune-Inflammatory) 관련 질환에 대한 치료제 개발 기업으로, 건선(Psoriasis), 건선형 관절염(Psoriatic arthritis), 암(Cancer), 골수성 백혈병(Myelogenous leukemia), 섬유 질병(Fibrotic disease) 등에 대한 파이프라인을 보유하고 있다. 2002년에는 생물학적 치료제 및 제대혈 은행(Cord blood banking) 사업과 관련해 Anthrogenesis Corp.를 인수하여 Celgene Cellular Therapeutics(CCT)라는 이름으로 기업을 확장하였고, 이를 통해 줄기세포 은행인 'Lifebank USA'를 비롯해 상처 치료를 위한 'Biovance', 'Acelagraft' 등의 상품을 판매하고 있다. 또한 자가 면역 질환(Auto Immune Disease) 및 암(Cancer)에 대한 세포 치료제 개발을 위해 인간 태반(Placenta) 및 제대혈(Umbilical cord)로부터 줄기세포를 분리하여 연구를 진행하고 있다.
▣ Cord Blood America [www.cordblood-america.com]
미국 내 제대혈(Umbilical cord) 보존 및 수집(Collection)-시험(Testing)-처리(Processing) 관련 업무를 담당하고 있는 기업으로, 2003년도에 설립되었다. 제대혈 외에도 미래의 줄기세포 치료제를 위한 개인별 말초 혈액(Peripheral blood) 및 지방(Adipose) 조직 줄기세포 보관 서비스를 제공하고 있다.
▣ Cord Blood Registry [www.cordblood.com]
Cord Blood Registry는 세계적으로 190,000명 이상의 신생아들에 대한 제대혈 줄기세포 보관을 통해, 세계에서 가장 큰 제대혈 줄기세포 은행으로의 발전을 꾀하고 있으며, Arizona州 Tucson에 위치한 연구소에서는 보관 시설 및 수집 방법 개선에 대한 연구를 진행하고 있다. 또한 최근에는 GE Healthcare, Thermogenesis 등과의 파트너십을 통해 세포 처리 과정에 대한 자동화 기술을 도입함으로써 자체 시스템 및 장비의 수준을 높여가고 있다.
▣ Cryo-Cell International [www.cryo-cell.com]
Cryo-Cell International, Inc.는 1989년도에 설립되었으며, 가족사용을 위한 제대혈 줄기세포의 냉동보관(Cryopreservation)을 주 사업으로 하고 있으며, C'elle라는 이름으로 여성 자신의 월경 줄기세포(Menstrual stem cell) 보관을 위한 세계 최초 서비스를 제공하고 있다.
▣ ES Cell International [www.escellinternational.com]
ES Cell International은 국제 줄기세포 산업계에서 급부상하고 있는 기업으로서 싱가포르(Singapore) 바이오폴리스(Biopolis)내의 the Institute for Molecular and Cell Biology(IMCB), Genome Institute of Singapore(GIS) 및 Novartis와 GlaxoSmithKline의 연구 기관에 위치를 하고 있다. 현재 미국 국립 보건원(U. S. National Institute of Health, NIH) 줄기세포 관리 목록에 등재되어 있는 21개의 인간 배아 줄기세포주(Human ES cell line) 중 6개를 보유하고 있으며, 당뇨(Diabetes)와 심부전(Heart failure)의 치료에 있어 세포 대치 치료법(Cell replacement therapy)을 개발하는데 중점을 두고 있다. 2007년 11월에는 세계 최초로 cGMP(current Good Manufacturing Practice) 기준에 부합하고, 임상 사용이 가능한 수준의 인간 배아 줄기세포를 개발했다고 발표한 바 있다.
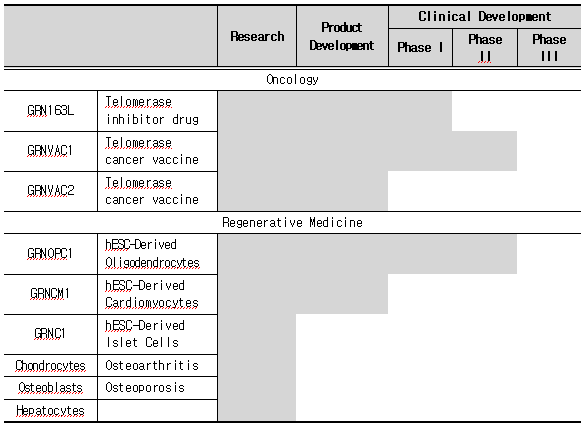
▣ Geron [www.geron.com]
1990년도에 설립되었으며, 척추 외상(Spinal cord injury), 심부전(Heart failure), 당뇨(Diabetes), HIV/AIDS를 포함한 만성 퇴행성 질환(Chronic degenerative disease)과 암(Cancer)의 치료를 위한 치료제 개발을 진행 중에 있다. 또한 텔로머라아제 억제제(Telomerase inhibitor)를 포함한 몇 가지의 기술들과 텔로머라아제 검출(Detection)에 기반을 둔 진단(Diagnostics) 기술들을 연구하고 있으며, GRNOPC1을 포함하는 인간 배우 줄기세포 치료제 역시 연구·개발 중에 있다. GRNOPC1은 척추 외상 치료를 타깃으로 하는 회돌기교질 선구 세포(Oligodendroglial progenitor cell)들을 포함하고 있으며, 심근 세포(Cardiomyocyte)들의 집합체인 GRNCM1은 심근 질환(Myocardial disease) 환자의 치료를 위해 개발 중이다.
▣ Harvest Technologies [www.harvesttech.com]
1995년도에 설립되었으며, 미국에서는 ‘Platelet Concentrate System'이라는 이름으로 자가(Autologous) 생체 적응 재료(Biomaterial) 수집을 위한 상품을 출시했고, 유럽에서는 정형외과 수술 의사로 하여금 성장 인자(Growth factor), 트롬빈 활성물질(Thrombin activator), 자가 줄기세포를 수집하는 기술 플랫폼인 SmartPReP2를 판매하고 있다.
▣ Invitrogen [www.invitrogen.com]
1987년도에 설립되었으며, 현재 생명 과학 연구, 약물 개발, 진단 의학, 생물학적 제제의 개발, 생산, 마케팅 생산 등에 필요한 시약들을 판매하고 있는 세계적인 기업이다. Invitrogen은 BioDiscovery와 Cell Culture Systems라는 두 개의 사업 부문으로 나뉘어 운영되고 있는데, BioDiscovery 사업 부문에는 기능 유전체학(Functional genomics), 세포 생물학(Cell biology), 약물 개발(Drug discovery) 라인의 제품들이 있고, Cell Culture Systems 부문에서는 생명 과학 연구와 제약 및 세포 배양을 통해 생산되는 제품들을 위한 혈청(Serum, sera), 성장 인자, 세포 및 조직 배양 미디어(Media) 등을 제공하고 있다. 줄기세포 기술과 관련하여 Invitrogen은 줄기세포 성장 및 분화에 관련된 1200여개 이상의 제품을 가지고 있으며, 배아 및 성체 줄기세포 연구 과정의 다양한 단계들에서 사용되고 있다. 최근에 나온 신제품 중의 하나로 STEMPRO hESC SFM이란 제품은 배아 줄기세포가 만능성(Pluripotency)을 유지하면서 성장할 수 있게 해주는 미디어 역할을 한다.
▣ Medistem [www.medisteminc.com]
Medistem Laboratories는 성체 줄기세포(Adult stem cell) 기반 치료제의 개발과 상품화를 목적으로 하고 있다. 그러나 개발된 치료제의 판매를 목적으로 하는 다른 줄기세포 연구 회사들과는 다르게, Medistem Laboratories는 세계 각국의 임상 기관 및 연구소들과의 네트워크를 형성하여 환자에게 적합한 치료방법(제)을 직접 제공한다는 계획을 가지고 있다.
▣ Neostem [www.neostem.com]
2002년도에 Corniche Group Inc.로 설립되어 2006년도에 Neostem, Inc.로의 전환이 되었으며, 미국 내의 자가(Autologous) 사용을 위한 성체 줄기세포의 수집-처리-냉동보관 과정에 관여하고 있는 기업이다. Neostem의 타깃 시장(Market)은 HIV 또는 활성 간염(Active Hepatitis)을 보유하지 않고, 임신 중이 아니며, 최소 110 lbs(Pound)(=49.8kg) 이상의 몸무게를 가진 사람들이며, 차후 심각한 의학적 필요가 있을 때 사용하기 위한 줄기세포 보관 서비스를 제공하고 있다.
▣ Opexa Therapeutics [www.opexatherapeutics.com]
자체적으로 보유한 T 세포 및 성체 줄기세포 기술들에 기반을 두어 다발성경화증(Multiple sclerosis, MS), 류마티스 관절염, 당뇨, 심혈관(Cardiovascular) 질환 등의 자가(Autologous) 세포 치료제 개발을 진행 중이며, Opexa Therapeutics의 대표적인 품목으로는 다발성 경화증에 대한 T 세포 기반 치료 백신인 'Tovaxin'을 들 수 있다. 'Tovaxin'은 자가 면역 미엘린 펩티드 활성화 T 세포(Autoimmune myelin peptide-reactive T cell)에 대해 면역 반응을 유발시키며, 임상 2b 상을 진행 중이다. 또한 류마티스 관절염에 대한 T 세포 백신 기술의 라이선스를 가지고 있으며, 자가 치료사용을 위해 말초 혈액(Peripheral blood)의 단핵 세포(Mononuclear cell)로부터 다분화성(Multipotent) 성체 줄기세포를 생산하는 기술에 대해서도 라이선스를 보유하고 있다.
▣ Osiris Therapeutics [www.osiristx.com]
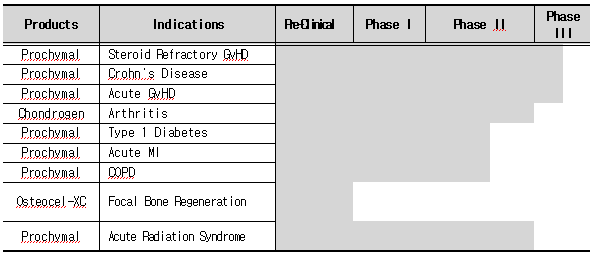
Osiris Therapeutics는 염증(Inflammatory), 정형외과(Orthopedic), 심혈관(Cardiovascular) 질환에 초점을 맞추어 성인 골수(Bone marrow)로부터 분리한 줄기세포를 상업화하고 있는 기업이다. 척추 고정술(Spinal fusion) 및 기타 정형 외과적 시술에 사용되는 ‘Osteocel'을 비롯해 스테로이드 난치성 이식 편대 숙주 질환(steroid refractory Graft-versus-Host Disease), 급성 이식 편대 숙주 질환(Acute GvHD), 크론씨병(Crohn's disease)의 치료제로 임상 2, 3상을 진행 중인 'Prochymal' 등 기업의 모든 생산품은 인간 중간엽(Mesenchymal) 줄기세포를 기반으로 하고 있다. 이 외에도 반월판 재생(Meniscus regeneration)과 연골 보호(Cartilage protection)의 치료제로 임상 1, 2상을 진행 중인 ’Chondrogen'과 심근 경색(Heart attack) 후 수반되는 심장 조직의 회복을 위한 치료제로 임상 1상을 진행 중인 ‘Provacel' 등이 있다. JCR Pharmaceuticals Co., Ltd.와 전략적 제휴 관계에 있으며, Boston Scientific Corporation과는 심근경색증(Myocardial infarction)과 만성 허혈(Ischemia) 치료를 위한 중간엽 줄기세포(MSC) 기술 개발을 공동으로 진행하고 있다.
▣ Plureon [www.plureon.com]
2002년 설립되었으며, Havard Medical School의 교육 기관인 the Laboratory for Cell Therapy and Tissue Engineering of Children's Hospital Boston에서의 원천 기술 개발을 목표로 하고 있다.
2002년 설립되었으며, Havard Medical School의 교육 기관인 the Laboratory for Cell Therapy and Tissue Engineering of Children's Hospital Boston에서의 원천 기술 개발을 목표로 하고 있다.
▣ Regenetech [www.regenetech.com]
미국 항공 우주국(National Aeronautics and Space Administration, NASA)의 라이선스 기술 개발을 위해 BioCell Innovations라는 이름으로 2002년도에 설립되었으며, 현재는 Regenetech으로 운영되고 있다. NASA에서 개발된 Intrifuge cellXpansion 플랫폼을 기본 기술로 가지고 있으며, 겸상 적혈구 빈혈증(Sickle cell disease)에 대한 줄기세포 기술의 예비 시험을 완료한바 있다.
▣ Revivicor [www.revivicor.com]
2003년도에 설립되었으며, 인체 이식(Transplantation)을 위한 가공 조직(Engineered tissue)과 기관(Organ) 개발을 목표로 하고 있다. 현재 이식 수술의 사용을 목적으로 인체에 대응하는 세포, 조직, 기관 등을 만들기 위한 유전자 조작 돼지(Genetically modified pig) 생산을 진행하고 있으며, 돼지-영장류(Pig-to-primate) 사이의 이식 연구도 진행을 하고 있다.
▣ Stem Cell Sciences [www.stemcellsciences.com]
1994년도에 설립된 후 현재 불치병을 위한 세포 기반 치료제 개발을 목표로 배아 줄기세포와 신경 줄기세포(Neural stem cell, NSc)의 분리, 분화, 성장에 관련된 기술을 연구·개발하고 있으며, 성체 및 배아 줄기세포 분야를 비롯해 고순도로 분리된 줄기세포와 분화 선구 세포(Progenitor cell)를 생산하기 위한 기술면에서 특허 관련 포트폴리오를 구성·보유하고 있다. Pfizer, Sanofi-Aventis, Merck, GlaxoSmithKline, Chemicon, Deltagen, Lexicon 등 다양한 글로벌 헬스케어 기업들과의 파트너십 형성을 비롯해, 캠브리지(Cambridge) 대학의 the Wellcome Trust Centre for Stem Cell Research, 에딘버그(Edinburgh) 대학의 the Institute of Stem Cell Research, 일본 고베(Kobe)의 RIKEN Centre for Developmental Biology, 멜버른(Melbourne)의 the Australian Stem Cell Centre 등의 연구소들과도 네트워크를 형성하여 공동 연구를 진행하고 있다.
1994년도에 설립된 후 현재 불치병을 위한 세포 기반 치료제 개발을 목표로 배아 줄기세포와 신경 줄기세포(Neural stem cell, NSc)의 분리, 분화, 성장에 관련된 기술을 연구·개발하고 있으며, 성체 및 배아 줄기세포 분야를 비롯해 고순도로 분리된 줄기세포와 분화 선구 세포(Progenitor cell)를 생산하기 위한 기술면에서 특허 관련 포트폴리오를 구성·보유하고 있다. Pfizer, Sanofi-Aventis, Merck, GlaxoSmithKline, Chemicon, Deltagen, Lexicon 등 다양한 글로벌 헬스케어 기업들과의 파트너십 형성을 비롯해, 캠브리지(Cambridge) 대학의 the Wellcome Trust Centre for Stem Cell Research, 에딘버그(Edinburgh) 대학의 the Institute of Stem Cell Research, 일본 고베(Kobe)의 RIKEN Centre for Developmental Biology, 멜버른(Melbourne)의 the Australian Stem Cell Centre 등의 연구소들과도 네트워크를 형성하여 공동 연구를 진행하고 있다.
▣ StemLifeLine [www.stemlifeline.com]
2007년도에 설립 된 생명 과학 기업으로, 시험관 아기를 위한 체외 수정(in vitro fertilization) 프로그램을 가지는 개인들을 대상으로 해 잉여 배아(Remaining stored embryo)로부터 줄기세포주(Stem cell line) 개발 과정을 최초로 제공하고 있다. 체외 수정 과정에서 폐기되는 배아들을 개개인별 줄기세포주로 전환시켜줌으로써 고객들로 하여금 줄기세포 치료를 위한 기회를 가지게 할 수 있으며, 줄기세포를 분리하고 20년간 보관하는데 평균 $16,000 ~ $18,000의 비용이 드는 것으로 알려져 있다.
▣ Thermogenesis [www.thermogenesis.com]
Thermogenesis는 1985년도에 설립된 ISO 인증 기업으로, 혈액 처리 과정과 병원에서의 상처 치료 과정에 있어서 혁신적인 시스템 개발을 목표로 하고 있다. 핵심 상품으로는 'BioArchive System'-이식을 위한 줄기세포 보관 및 냉동 보존 기술로 제대혈 은행에서 사용되고 있음-, ‘CryoSeal FS System'-환자의 혈액으로부터 자가성 지혈제(Autologous hemostatic) 및 접착성 수술 밀폐제(Adhesive surgical sealant)를 분리하는 시스템-과 다양한 냉동·해동 시스템들이 있다. Thermogenesis는 세계 최초로 약 한 시간 내에 환자의 혈액으로부터 100% 자가 섬유소 밀폐제(Autologous fibrin sealant)를 생산할 수 있는 시스템을 개발한 바 있다.
▣ VetCell Bioscience [www.vetcell.com]
VetCell은 손상된 또는 질환 조직의 재생과 기능 회복을 위한 세포 치료제에 기반을 둔 새로운 기술들의 상업화를 목표로 하고 있으며, 현재는 수의학(Veterinary), 특히 말(Equine)에 적용하는 것을 중점으로 두고 있다.
▣ ViaCell [www.viacellinc.com]
ViaCell은 ‘Viacord'란 이름으로 아기(Baby)의 제대 혈액(Umbilical cord blood)을 보존해주는 상품을 제공하고 있으며, 2007년도에만 130,000명 이상의 신생아 제대 혈액을 보존해 주었다. 또한 ’ViaCyte'란 상품을 통해 인간 미수정란(Unfertilized egg) 냉동 보존을 제공하고 있으며, 추가적으로 제대혈에서 분리된 줄기세포의 치료제로서의 가능성에 대해서도 연구를 진행 중이다. 암(Cancer), 심장 질환(Cardiac disease), 당뇨(Diabetes) 등의 분야에 집중적인 파이프라인을 가지고 있다.
V. 참고 문헌
1. 최진영, SERI 경제 포커스, 삼성경제연구소, 2009년 3월, 제234호.
2. 김현철, 세포치료제 시장동향 및 전망, 한국보건산업진흥원, 2005년 8월
3. Adhikary, S., and Eilers, M. Transcriptional regulation and transformation by Myc proteins.
2. 김현철, 세포치료제 시장동향 및 전망, 한국보건산업진흥원, 2005년 8월
3. Adhikary, S., and Eilers, M. Transcriptional regulation and transformation by Myc proteins.
Nature reviews 6:635-645, 2005.
4. Alison Sahoo, Stem cell markets, Kalorama Information Market Intelligence Report, March,
4. Alison Sahoo, Stem cell markets, Kalorama Information Market Intelligence Report, March,
2008.
5. Aoi, T., Yae, K., Nakagawa, M., Ichisaka, T., Okita, K., Takahashi, K., Chiba, T., and
5. Aoi, T., Yae, K., Nakagawa, M., Ichisaka, T., Okita, K., Takahashi, K., Chiba, T., and
Yamanaka, S. Generation of Pluripotent Stem Cells from Adult Mouse Liver and Stomach
Cells. Science [Epub ahead of print], 2008.
6. Brambrink, T., Foreman, R., Weistead, G., Lengner, C., Wernig, M., Suh, H., and Jaenisch,
6. Brambrink, T., Foreman, R., Weistead, G., Lengner, C., Wernig, M., Suh, H., and Jaenisch,
R. Sequential expression of pluripotency markers during direct reprogramming of mouse
somatic cells. Cell Stem Cell 2: 151-159, 2008.
7. Burdon, T., Stracey, C., Chambers, I., Nichols, J., and Smith, A. Suppression of SHP-2 and
7. Burdon, T., Stracey, C., Chambers, I., Nichols, J., and Smith, A. Suppression of SHP-2 and
ERK signalling promotes self-renewal of mouse embryonic stem cells. Developmental
biology 210: 30-43, 1999.
8. Cowan, C.A., Atienza, J., Melton, D.A., and Eggan, K. Nuclear reprogramming of somatic
8. Cowan, C.A., Atienza, J., Melton, D.A., and Eggan, K. Nuclear reprogramming of somatic
cells after fusion with human embryonic stem cells. Science 309: 1369-1373, 2005.
9. Hanna, J., Wernig, M., Markoulaki, S., Sun, C.W., Meissner, A., Cassady, J.P., Beard, C.,
9. Hanna, J., Wernig, M., Markoulaki, S., Sun, C.W., Meissner, A., Cassady, J.P., Beard, C.,
Brambrink, T., Wu, L.C., Townes, T.M., et al. Treatment of sickle cell anemia mouse model
with iPS cells generated from autologous skin. Science 318: 1920-1923, 2007.
10. Joseph Panno, Stem cell research : Medical Applications and ethical controversy, Facts
10. Joseph Panno, Stem cell research : Medical Applications and ethical controversy, Facts
on file science library, 2005.
11. Lan Kang, Jianle Wang, Yu Zhang, Zhaohui Kou, Shaorong Gao, iPS cells can support
11. Lan Kang, Jianle Wang, Yu Zhang, Zhaohui Kou, Shaorong Gao, iPS cells can support
full-term development of tetraploid blastocyst-complemented embryos, Cell Stem Cell, vol.
5, Issue 2, 135-138, 23th, July, 2009.
12. Lowry, W.E., Richter, L., Yachechko, R., Pyle, A.D., Tchieu, J., Sridharan, R., Clark, A.T.,
12. Lowry, W.E., Richter, L., Yachechko, R., Pyle, A.D., Tchieu, J., Sridharan, R., Clark, A.T.,
and Plath, K. Generation of human induced pluripotent stem cells from dermal fibroblasts.
Proc. Nat. Acad. Sci. USA, 2008.
13. Maherali, N., Sridharan, R., Xie, W., Utikal, J., Eminli, S., Arnold, K., Stadtfeld, M.,
13. Maherali, N., Sridharan, R., Xie, W., Utikal, J., Eminli, S., Arnold, K., Stadtfeld, M.,
Yachechko, R., Tchieu, J., Jaenisch, R., et al. Directly reprogram medfibroblasts show
global epigenetic remodeling and wide spread tissue contribution. Cell Stem Cell 1: 55-70,
2007.
14. R. Passier, LWv Laake, CL Mummery, Induced pluripotent stem cells and transplantation
14. R. Passier, LWv Laake, CL Mummery, Induced pluripotent stem cells and transplantation
therapy, Nature 453, 322, 2008.
15. Research Impact Technologies, Stem Cell Research-A Market Insight Report, May, 2008.
16. Takahashi, K., and Yamanaka, S. Induction of pluripotent stem cells from mouse
15. Research Impact Technologies, Stem Cell Research-A Market Insight Report, May, 2008.
16. Takahashi, K., and Yamanaka, S. Induction of pluripotent stem cells from mouse
embryonic and adult fibroblast cultures by defined factors. Cell 126:663-676, 2006.
17. Taranger, C.K., Noer, A., Sorensen, A.L., Hakelien, A.M., Boquest, A.C., and Collas, P.
17. Taranger, C.K., Noer, A., Sorensen, A.L., Hakelien, A.M., Boquest, A.C., and Collas, P.
Induction of dedifferentiation, genomewide transcriptional programming, and epigenetic
reprogramming by extracts of carcinoma and embryonic stem cells. Mol Biol Cell. 16:
5719-5735, 2005.
18. Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein,
18. Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein,
B.E., and Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like
state. Nature 448: 318-324, 2007.
19. Wilmut, I., Schnieke, A.E., McWhir, J., Kind, A.J., and Campbell, K.H. Viable offspring
19. Wilmut, I., Schnieke, A.E., McWhir, J., Kind, A.J., and Campbell, K.H. Viable offspring
derived from fetal and adult mammalian cells. Nature 385: 810-813, 1997.
20. Xiao-yang Zhao, Wei Li, Zhuo Lv, Lei Liu, Man Tong, Tang Hai, Jie Hao, Chang-long Guo,
20. Xiao-yang Zhao, Wei Li, Zhuo Lv, Lei Liu, Man Tong, Tang Hai, Jie Hao, Chang-long Guo,
Qing-wen Ma, Liu Wang, Fanyi Zeng, Qi Zhou, iPS cells produce viable mice through
tetraploid complementation, Nature advance online publication 23th, July, 2009.
21. Xu, C., Rosler, E., Jiang, J., Lebkowski, J.S., Gold, J.D., O'Sullivan, C.,Delavan-Boorsma,
21. Xu, C., Rosler, E., Jiang, J., Lebkowski, J.S., Gold, J.D., O'Sullivan, C.,Delavan-Boorsma,
K., Mok, M., Bronstein, A., and Carpenter, M.K. Basic fibroblast growth factor supports
undifferentiated human embryonic stem cell growth without conditioned medium. Stem cells
(Dayton, Ohio)23: 315-323, 2005.
22. http://stemcells.nih.gov/
22. http://stemcells.nih.gov/
source: BioIn
 줄기세포연구개발_동향보고서.pdf
줄기세포연구개발_동향보고서.pdf